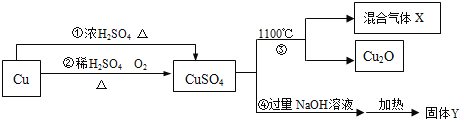
题目内容
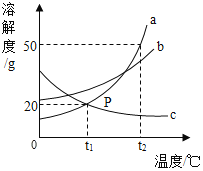
【题目】如图是a、b、c三种固体物质的溶解度曲线,请回答下列问题。
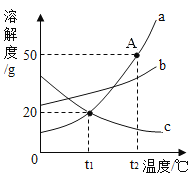
(1)A点的含义是_____________________________。
(2)气体的溶解度随温度的变化规律与__________(填“a”、“b”或“c”)相似。
(3)若使a、c的饱和溶液同时析出晶体,方法是___________。
(4)在t2℃时,a、b、c三种饱和溶液降温至t1℃时溶质的质量分数由大到小的顺序是_____________________。
【答案】在t2℃时a物质的溶解度是50g c 蒸发溶剂 b>a>c
【解析】
(1)根据溶解度曲线可知,A点表示在t2℃时a物质的溶解度是50g;
(2)气体溶解度随温度的升高而减小,故气体的溶解度随温度的变化规律与c相似,故填:c;
(3)使a、c的饱和溶液同时析出晶体,需要采用蒸发溶剂的方法;
(4)将t2℃时a、b、c三种物质的饱和溶液降温到t1℃时,a、b的溶解度减小,c的溶解度随温度的降低而增大,a、b有晶体析出,质量分数变小溶液仍为饱和溶液,c没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质质量分数=![]() ,溶解度越大,质量分数越大,t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是b>a>c。
,溶解度越大,质量分数越大,t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是b>a>c。

练习册系列答案
相关题目
【题目】某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如下表所示。
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的pH |
① | 30g | pH<7 |
② | 40g | pH=7 |
③ | 50g | pH>7 |
若一定量石油产品中残余硫酸的质量为100 g,请计算该残余硫酸的溶质质量分数(写出详细的计算过程)。__________