题目内容
【题目】化学研究物质的组成。
① CaCO3是大理石的主要成分,它由________种元素组成,1 mol CaCO3中约含有_______个碳原子,实验室用大理石与稀盐酸反应制取二氧化碳,反应的化学方程式是_______。
② 如图一所示的装置可以研究水的组成。b处产生的气体是________,反应的化学方程式是 ___________。
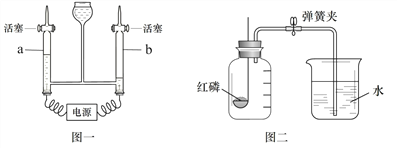
③ 用如图二所示的装置可以粗略的测定空气中氧气的体积分数。红磷燃烧的现象是_____,反应结束待______后打开弹簧夹,若实验成功,观察到的现象是_________。
【答案】 3 6.02×1023 CaCO3 + 2HCl![]() CaCl2 + H2O + CO2
CaCl2 + H2O + CO2![]() 氢气(或H2)
氢气(或H2) ![]() 大量白烟、发光、放热 冷却到室温 水倒流 至集气瓶容积的五分之一
大量白烟、发光、放热 冷却到室温 水倒流 至集气瓶容积的五分之一
【解析】①CaCO3是大理石的主要成分,它由C、H、O三种元素组成,一个碳酸钙的分子中有1个碳原子,所以1mol CaCO3中约含有1mol碳原子,即约含有6.02×1023个碳原子;实验室用大理石与稀盐酸反应来制取二氧化碳气体,化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;②图一是电解水的实验装置,b处产生的气体较多,是氢气,a处产生的气体较少,是氧气,反应的化学方程式是2H2O通电 2H2↑+O2↑;③由于磷燃烧生成五氧化二磷是白色固体,现象是产生大量白烟、发光、放热,反应结束待后打开弹簧夹,若实验成功,观察到的现象是水倒流至集气瓶容积的五分之一.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目