题目内容
【题目】为探究金属的化学性质,进行下图所示实验。
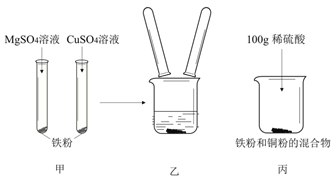
①甲图中发生反应的化学方程式为________;Mg、Cu、Fe的金属活动性由强到弱的顺序是______。
②如乙图所示,将甲图实验反应后的物质倒入烧杯中,发现烧杯内的红色固体明显增多,充分反应后过滤。有关说法正确的是________。
A.滤液中一定没有CuSO4
B.滤渣中一定没有Mg、Fe
C.滤液中一定含有MgSO4、FeSO4
D.滤渣中一定含有Cu,可能含有Fe
③ 在丙图所示的实验过程中有关物质的质量随反应时间的变化关系如下图,正确的是_______(填序号)。
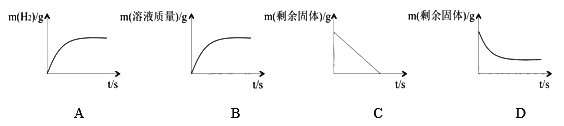
【答案】(1)CuSO4+ Fe----Cu + FeSO4(2)Mg>Fe>Cu(3)CD(4)AD
【解析】试题分析:甲图中发生反应的化学方程式为CuSO4+ Fe----Cu + FeSO4;Mg、Cu、Fe的金属活动性由强到弱的顺序是Mg>Fe>Cu。如乙图所示,将甲图实验反应后的物质倒入烧杯中,发现烧杯内的红色固体明显增多,充分反应后过滤。滤液中一定含有MgSO4、FeSO4,因为镁的活动性最强,而铁一定会置换铜,所以滤渣中一定含有Cu,可能含有Fe,在丙图所示的实验过程中有关物质的质量随反应时间的变化关系正确的是AD,因为铁会和硫酸发生反应产生氢气,所以A正确;因为能够发生反应的是铁,而铜不会发生反应,所以最终还有固体剩余。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目