题目内容
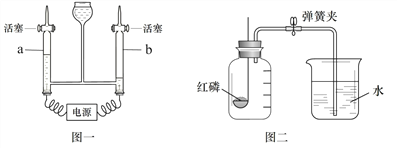
【题目】实验室常用的气体制取装置如下,请回答。
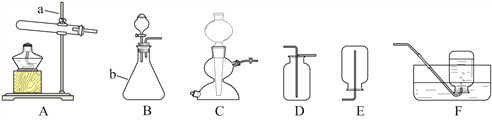
① 写出编号仪器的名称:a_____;b_____。
② 选用装置B作为制取氧气的发生装置,反应的化学方程式是______,能否选用装置C来随时控制该反应的发生和停止?说明理由______。
③ 收集氧气和二氧化碳都可以选择的装置是_________。(填装置编号)
④ 加热一定质量的氯酸钾与二氧化锰的混合物,根据需要产生0.3mol氧气后停止加热,请计算发生反应的氯酸钾的质量是多少克?(请根据化学方程式列式计算)_______。
⑤ 请分析④中反应后剩余固体的成分:________。
【答案】 铁架台 锥形瓶 ![]() 不可以,因为二氧化锰是粉末状无法做到固液分离(对应正确给分;若写“可以”则其应与原因对应正确,合理给分) D 解:设发生反应的氯酸钾的物质的量是x mol
不可以,因为二氧化锰是粉末状无法做到固液分离(对应正确给分;若写“可以”则其应与原因对应正确,合理给分) D 解:设发生反应的氯酸钾的物质的量是x mol
2KClO3 ![]() 2KCl+3O2
2KCl+3O2![]()
2 3
x 0. 3
![]()
x=0.2mol
m(KClO3)=0.2mol×122.5g/mol=24.5g 一定有氯化钾、二氧化锰、可能有氯酸钾
【解析】(1).如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,反应方程式为:2H2O2 MnO2 2H2O+O2↑;不能用装置C来随时控制该反应的发生和停止,理由是二氧化锰是粉末状无法做到固液分离(2)二氧化碳和氧气的密度都比空气的大,都可以用向上排空气法收集,所以都可以选用收集装置D(3)设设发生反应的氯酸钾的物质的量是x
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
2 3
x 0.3mol
![]()
x=0.2mol
氯酸钾的质量=0.2mol×122.5g/mol=24.5g (7). 由方程式可知反应生成氯化钾,反应后的固体中一定有氯化钾;二氧化锰是氯酸钾分解的催化剂,反应前后物质的质量和化学性质不变,所以反应后一定有二氧化锰;如果氯酸钾有剩余则还有有氯酸钾

【题目】某校化学兴趣小组在做铁有酸反应的实验时,由于拿错了药品,酸可能使用了浓硫酸,发现生成的气体不是氢气,因此他们进行了探究实验.
【提出问题】铁与硫酸溶液反应生成的气体为什么不是氢气?
【网络资料】(1)铁与浓硫酸反应会生成二氧化硫
(2)SO2可使品红溶液褪色,H2不会使品红溶液褪色
(3)NaOH溶液能吸收SO2
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产物中可能有二氧化硫.
【实验探究】小明用图甲所示装置进行探究实验,并用排水法收集气体进行如图乙所示的实验.
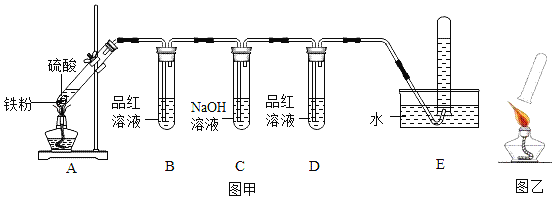
请帮助小明完成下表:
硫酸浓度 | 实验现象 | 气体产物的成分 | |||
B中品红溶液 | D中品红溶液 | 爆鸣实验 | |||
实验一 | 95% | _____ | 不褪色 | 无爆鸣声 | 只有SO2 |
实验二 | 48% | 稍有褪色 | 不褪色 | 有爆鸣声 | ______ |
实验三 | 20% | ________ | 不褪色 | ______ | 只有H2 |
【实验结论】铁与不同浓度的硫酸溶液反应,生成的气体产物可能不同,当硫酸浓度较大时,气体产物中就有二氧化硫.
【思考与分析】
(1)做该实验时,在连接仪器之后和装药品之前应该进行的实验操作是______________.
(2)实验三中铁与硫酸溶液发生反应的化学方程式为________________.
【拓展延伸】试写出初中学过的由于反应物的浓度不同,导致生成物不同的例子:___________________。