题目内容
【题目】聪聪同学在实验室帮老师整理废弃药品时发现一瓶没有标签的绿色粉末,对其组成很好奇.征得老师允许后,设计了以下实验进行探究.
操作步骤 | 实验现象 | 结论或化学反应方程式 |
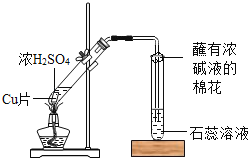
取少量样品置于试管中,加入足量稀硫酸,将试管用导管与澄清石灰水相连. | ①产生大量气体,使石灰水变浑浊. ②样品全部溶解,溶液呈蓝色. | ①样品中含有_____离子 ②样品中含有_____离子 |
在上述蓝色溶液中,插入一根洁净的铁丝. | ①铁丝表面缓缓产生少量气泡. ②片刻后铁丝表面出现红色物质. | ①_____ ②_____ (均用方程式表示) |
为了进一步确定该物质的元素组成,查阅部分资料后,他继续进行了实验.
[资料查阅]白色的无水硫酸铜可做吸水剂,遇水会变成蓝色.
[实验步骤]
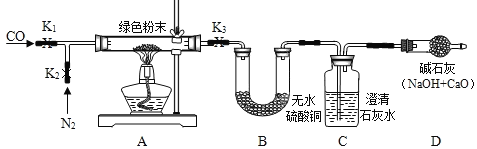
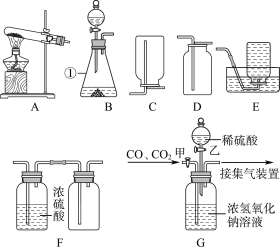
①如图搭建实验仪器,并检验装置的气密性.
②在A装置中装入11.1g绿色粉末.关闭K1,打开K2、K3,持续通入适量N2.
③关闭K2、K3,分别称量装置B、C、D的质量,记录数据.
④打开K3,点燃酒精灯加热绿色粉末直至装置C中无气泡产生时,关闭K3,熄灭酒精灯.分别称量装置B、C、D的质量,记录数据.
⑤待A冷却后,打开K1、K3,持续通入适量CO,再次点燃酒精灯加热.
⑥当A中粉末全部变红后,熄灭酒精灯.试管冷却后,关闭K1.称量装置A、B、C、D的质量,记录数据.
[实验现象和数据处理]
装置A | 装置B | 装置C | 装置D | |
第一次 加热后 | 绿色粉末变黑色 | _____ 质量增加0.9g | 出现白色沉淀, 质量增加2.2g | 无明显变化 质量不改变 |
第二次 加热后 | 黑色粉末变红色 质量为6.4g | 无明显变化, 质量不改变 | 沉淀先增加后部分溶解; 质量增加 | 无明显变化 质量不改变 |
[实验分析与反思]
1、老师看了实验方案后认为,从环保的角度来看,此装置有一个缺陷,建议装置D后还应添加一个酒精灯,并在实验步骤_____(填实验步骤的序号)中点燃.
2、步骤②通入氮气的目的是:_____.
[实验结论]该绿色粉末的组成元素是:_____;各元素的质量比为:_____(写出计算过程)
【答案】碳酸根(CO32-) 铜离子(Cu2+)
Fe+H2SO4====H2↑+FeSO4Fe + Cu SO4="==" Cu+FeSO4
【实验现象和处理】白色粉末变蓝色
【实验分析与反思】⑤ 将试管内的空气排尽,以免其中有物质和绿色粉末反应
【实验结论】 Cu、 C、O、H
Cu: C:H:O==64:6: 1:40(过程有错误不得分)
【解析】
由“与酸反应生成可使澄清石灰水变浑浊的气体”可推断出,样品中含有碳酸根(CO32-);“样品全部溶解,溶液呈蓝色”说明样品中含有 铜离子(Cu2+);过量的稀硫酸与铁反应产生少量气泡,Fe+H2SO4=FeSO4+H2↑,“铁丝表面出现红色物质”Fe+CuSO4=FeSO4+Cu;
【实验现象和处理】装置B质量增加0.9g,说明吸收了水蒸气,无水CuSO4遇水变蓝色。
【实验分析与反思】(1)由于CO有毒,故在通入CO前应先点燃酒精灯,实验步骤为⑤。
(2)步骤②通入氮气的目的是将试管内的空气排尽,以免其中有物质和绿色粉末反应。
【实验结论】由实验可知:该绿色粉末的组成元素是: Cu、 C、O、H; 铜元素的质量为6.4g,碳元素的质量为2.2g×12/44=0.6g,氢元素的质量为0.9g×2/18=0.1g,氧元素的质量=氧化铜中氧元素质量+0.9g水中氧元素的质量+2.2gCO2中的氧元素的质量=6.4g×16/64+0.9g×16/18+2.2g×32/44=4.0g。故各元素的质量比为Cu: C:H:O==6.4g:0.6g:0.1g:4.0g=64:6: 1:40。

【题目】在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.
探究一 M溶液中的溶质是什么?
(1)(提出猜想)该组同学认为M溶液的溶质有两种可能:
①是_____,②是CaCl2.
(收集资料)CaCl2水溶液呈中性.
(2)(设计实验)同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加_____. | _____ | 猜想①正确,碳酸钠与其反应的化学方程为_____. |
探究二 过滤后澄清滤液中会有哪些溶质?
(提出猜想)猜想一:NaOH和Na2CO3;猜想二:_____;猜想三:NaOH
(3)(实验验证)同学们针对“猜想一”进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | _____ | “猜想一”不成立 |
他们的实验结论是否正确?_____,理由是_____.
【题目】金属资源在生活中有着极其广泛的应用。
(1)铝的广泛存在及应用
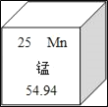
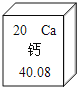
①铝在地壳中的含量居所有金属元素第_____位。
②铝是很活泼的金属,但用铝制作的炊具却耐腐蚀,其原因是_____(以方程式表示)。 长期使用铝制炊具会使人体摄入过量的“铝”,不利人体健康。这里的“铝”是指_____。
a单质 b元素 c原子 d分子
③明矾中也含有铝元素,生活中用明矾净水的原理是_____。
(2)铁的冶炼:图1为某钢铁公司的矿石选取、冶铁和炼钢的工艺流程。
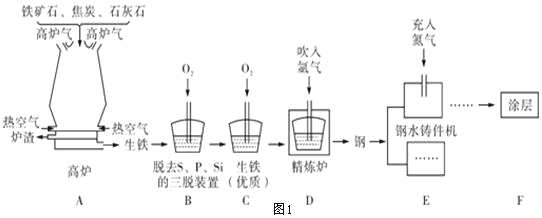
①用赤铁矿石冶铁的反应原理是_____(用化学方程式表示)。
②分析工艺流程,三脱装置中发生反应的化学方程式是_____(任写一个)。
③在钢水铸件机中,高温钢加工成钢制零件时,充入氮气的作用是_____。
(3)铁的防护:某同学为探究铁制品锈蚀的条件,进行如下实验:
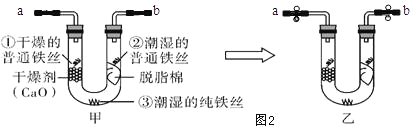
步骤 1:利用图甲所示装置,将干燥的O2从导管
a 通入U形管(装置气密性良好,药品如图甲所示);待U形管内充满O2,用止水夹夹紧导 管a、b 处连接胶皮管,如图乙所示。
步骤 2:一段时间后,观察U形管内的铁丝,其现象如表所示。
实验序号及对象 | 现象 |
①干燥的普通铁丝 | 没有明显变化 |
②潮湿的普通铁丝 | 较多红褐色锈斑 |
③潮湿的纯铁丝 | 没有明显变化 |
①步骤1中,如何证明U形管内O2已充满?_____。
②水是铁制品锈蚀的条件之一,此实验中_____(填实验序号)作对比能证明该结论。
③通过此实验还可得出影响铁制品锈蚀的因素是_____。