题目内容
电池是日常必备用品之一,但它也是环境污染的一个重要来源。下面是某兴趣小组利用废旧锌锰干电池作为原料,并进行相关探究的过程。
【知识储备】
(1)锌锰电池的构造和组成(见图)。
(2)结晶水合物的特殊性质:在逐步升高温度条件下,
结晶水合物能失去部分或者全部结晶水,如蓝色的胆矾
晶体(CuSO4 ?5H2O)受热时可失去结晶水变为白色的无
水硫酸铜粉末(CuSO4)。
(Ⅰ)制备皓矾晶体(ZnSO4?xH2O)
小组同学参观了某回收废旧锌锰电池的工厂,其回收工艺流程如图:
将滤液2蒸发浓缩、冷却结晶可得到皓矾晶体(ZnSO4?xH2O),蒸发时要用要用玻璃棒不断搅拌,目的是防止 引起液滴飞溅。
(Ⅱ)兴趣拓展——回收二氧化锰
实验(Ⅰ)中部分步骤可回收较纯净的二氧化锰固体。
 (1)小王同学认为试剂a为水,你认为能不能实现实验目的?答: 。
(1)小王同学认为试剂a为水,你认为能不能实现实验目的?答: 。
(2)在空气中充分灼烧的目的是 。
(Ⅲ)皓矾晶体中结晶水含量的测定
小组同学将部分皓矾晶体(ZnSO4?xH2O)带回实验室,用下图装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管)。
测定方法:称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水:
(ZnSO4?xH2O ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
(1)B中的试剂可从下列物质中选取,你的选择是 。
| A.浓硫酸 | B.硝酸银溶液 | C.饱和碳酸钠溶液 | D.澄清石灰水 |
(3)根据实验结果,计算皓矾晶体中结晶水的x值为 。
MnO2+C、 局部温度过高 能 除去碳 A 偏小 7
解析

(9分)实验室有半瓶敞口放置的标签残缺的白色固体(标签如图所示),小明、小亮根据初中所学的知识进行下列探究。
【交流讨论一】
(1)小明与小亮一致认为碱石灰的用途能
做干燥剂,理由是 。
(2)取适量该固体放入烧杯中,加入适量的水充分搅拌,发现
烧杯中有白色沉淀,烧杯外壁发热,于是小亮得出结论一定有生石灰。小明认为不一定,小明的理由是 。
(3)他俩将(2)烧杯中的混合物过滤,对滤液和白色沉淀的组成情况进行了进一步探究。
【猜测】Ⅰ.小明猜测滤液中的溶质是:①NaOH,②Ca(OH)2,③NaOH、Ca(OH)2,④Ca(OH)2、NaCO3,⑤NaCO3、 NaOH。
【交流讨论二】小亮认为小明的猜测中 (填序号)不合理,小亮猜测滤液中的溶质还可能是 。
【活动探究】小明对滤液中溶质的成分进行探究:(资料: BaCl2溶液显中性, BaCO3为不溶于水的白色固体)
| 实验步骤 | 实验现象 | 结论 |
| A.取少量滤液加入过量的BaCl2溶液中 | 产生白色沉淀 | 一定有 |
| B.将A中的混合物过滤,向滤液中加入 | | 一定有NaOH |
【交流讨论三】小亮根据小明的实验结论得出自己对白色沉淀的猜测中 (填序号)正确。
【启示】药品保存时应注意 。
(8分)氢氧化钠与盐酸的反应无明显现象,某化学兴趣小组为证明氢氧化钠与盐酸发生了化学反应,进行了如下的实验探究。
【实验探究一】小云在试管中加入约2mL稀氢氧化钠溶液,滴入2滴酚酞溶液,振荡,溶液变为红色。然后向该试管中滴加稀盐酸,观察到溶液 ,证明氢氧化钠与盐酸发生了反应,该反应的化学方程式为 。
【反思评价】 小霞提出也可以使用石蕊试液代替无色酚酞进行上述实验。你认为 (填“无色酚酞”或“石蕊试液”)更适合用于验证二者恰好完全反应,你的理由是 。
【实验探究二】小兰同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65﹪ | 2.00﹪ | 3.5 |
| 2 | 3.65﹪ | 4.00﹪ | x |
| 3 | 7.30﹪ | 8.00﹪ | 14 |
表中x = 。
【反思评价】某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。但有同学认为单凭此现象不足以说明该反应放热,其理由是 。

【拓展延伸】不是所有的碱与盐酸反应都无明显现象,例如 (填一种碱)与盐酸反应就有明显的实验现象。
(11分)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如下图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。
【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
久置固体中可能含有Ca(OH)2的原因是(用化学方程式表示) 。
【实验探究1】
甲同学的方案:
| 实验操作 | 实验现象 | 实验结论 |
| ⑴取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液。 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 | 固体中一定含有 ① 和氢氧化钙。 |
| ⑵另取少量固体放于试管中,滴加足量稀盐酸。 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有 ② , 一定不含Fe2O3。 |
| ⑶将步骤⑵中产生的气体通入到澄清的石灰水中。 | ③ | 固体中一定含有CaCO3。 |
⑴乙同学认为甲同学的实验中并不能得出一定含Ca(OH)2的结论,理由是
。
⑵丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是(用化学方程式表示) 、 。
【实验探究2】
乙、丙同学设计如下实验方案继续验证:

⑴ 乙、丙同学实验中又能得出固体样品中一定还含有 。
⑵ 乙同学经过实验测得上述滤渣C(CaCO3 )的质量为1.0 g,计算滤液A中含氢氧
化钙的质量。(写出解题过程)
⑶ 丙同学经过实验测得上述残留固体中含钙物质的总质量为1.6 g,滤渣B中CaCO3的质量为1.0 g。
【实验结论】综合上述实验以及乙、丙两位同学的实验数据,久置固体的成分是:
有一包固体粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠中的四种物质。某兴趣小组为确定其组成设计并进行如下实验。
【实验一】甲组同学进行如下探究。请完成表中空白。
| 实验操作 | 实验现象 | 实验结论及分析 |
| I.取少量该固体粉末于烧杯中,加入足量的水溶解、过滤 | 粉末部分溶解,得到白色滤渣和无色滤液 | 滤渣中一定含有 |
| Ⅱ.向滤液中粉末部分溶解,得到白色滤渣试液 | 溶液变红 | 滤液中可能含有 物质(填“酸性”、“碱性”或“中性”) |
| Ⅲ.向Ⅱ中所得溶液滴加足量稀盐酸 | | 原固体粉末中一定含有Na2CO3 |

实验测得固体B中含15 g氯元素。
试综合甲、乙两组同学的实验进行分析,填空。(C-12 O-16 Na-23 Cl-35.5)
⑴乙组实验中一定发生的化学反应是:Na2CO3+2HCl=2NaCl+H2O+CO2↑
⑵该固体粉末的组成可能是 。.
(7分)有一包白色固体样品,可能是碳酸钠、硫酸钡、氢氧化钠、氯化钡中的一种或几种。为探究其成分,小燕老师取用一定量样品,加足量水溶解,过滤得到白色沉淀甲和无色滤液乙。
写出上述操作中可能发生反应的化学方程式: 。
过滤时用到玻璃棒,玻璃棒的作用是 。
【探究活动一】 奋进小组探究白色沉淀甲的成分。
| 实验操作 | 实验现象 | 结 论 |
| 取白色沉淀甲,滴加足量的稀硝酸 | 沉淀部分消失 | 白色沉淀甲中一定含有 |
| 实验操作 | 实验现象 | 结论 | |
| 实验Ⅰ | 取适量无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含 |
| 实验Ⅱ | 步骤①:取适量无色滤液乙,加入过量的 溶液,过滤 | 生成白色沉淀 | 原白色固体样品中一定存在该物质 |
| 步骤②:取步骤①中的滤液,滴加 溶液 | | ||
【结论】 通过两个小组的共同探究,得出了原白色固体样品含有的成分。
(18分)工业烧碱(NaOH)具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠。某化学学习小组同学围绕工业烧碱展开系列研究。
探究一:工业烧碱中是否含有碳酸钠
【查阅资料】碳酸钠和氯化钙能发生复分解反应。
小红指出可选用下列实验药品来探究:稀盐酸、酚酞试液、CaCl2溶液。
(1)小组同学经过讨论后,一致认为使用 药品不能达到探究目的,理由是 。
(2)请根据选用的实验药品完成下列实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量工业烧碱样品配成溶液后,滴加过量 | | 工业烧碱中含有碳酸钠,产生实验现象的化学方程式: 。 |
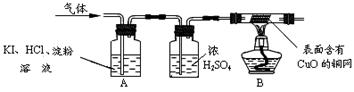
小组同学利用下图所示装置测定工业烧碱样品的纯度(固定装置省略)

【实验步骤】
①按图连接装置,并检查装置的气密性;
②称量一定量的烧碱样品和干燥管C的质量;
③打开弹簧夹K,鼓入N2一段时间;
④接入装置C、D,关闭弹簧夹K,装置A中加入稀硫酸,至不再产生气泡为止;
⑤重复步骤③操作,至干燥管C质量不再增加。
试回答下列相关问题:
(1)装置B中浓硫酸的作用是 ;已知碱石灰的主要成分是CaO和NaOH,则装置D的作用是 。
(2)步骤③操作的目的是 ;如果步骤⑤没有重复步骤③的操作,则测定烧碱样品的纯度将 (选填“偏高”、“偏低”或“无影响”)。
(3)步骤⑤中干燥管C质量不再增加,说明 ,写出NaOH与生成的气体反应的化学方程式: 。
(4)下列操作会影响到测量结果的是 (填序号)。
A.把稀硫酸改为稀盐酸 B.稀硫酸过量
C.鼓入N2时间较长 D.省略装置D