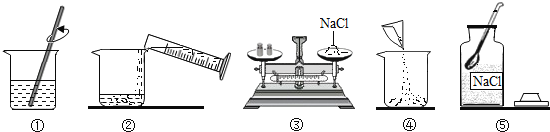
题目内容
【题目】某科研小组设计利用稀硫酸浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)的方案,实现废物综合利用。部分实验流程如下:
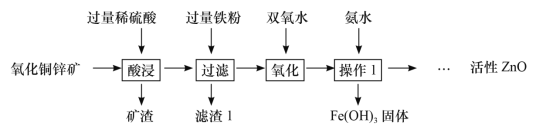
请根据上述实验流程回答下列问题:
(1)操作1的名称是_____。
(2)在氧化铜锌矿中加入过量稀硫酸,充分反应后溶液中的溶质为_____。
(3)加过量铁粉,发生反应的化学方程式为_____。
(4)在实验过程中,双氧水会与![]() 反应生成
反应生成![]() 和水,以便在后续的操作中将溶液中铁元素除去,高锰酸钾溶液也能将
和水,以便在后续的操作中将溶液中铁元素除去,高锰酸钾溶液也能将![]() 氧化成
氧化成![]() ,并生成可溶性的锰盐,选用双氧水的优点是_____。
,并生成可溶性的锰盐,选用双氧水的优点是_____。
【答案】过滤 ZnSO4、CuSO4、H2SO4 Fe+CuSO4=FeSO4+Cu、Fe+H2SO4=FeSO4+H2↑ 最后的产物是水,不引入新的杂质
【解析】
(1)分离固体和液体的操作是过滤。
(2)氧化铜和硫酸反应生成硫酸铜,氧化锌和硫酸反应生成硫酸锌。
(3)金属活动性顺序中,铁在锌后面,在氢元素、铜的前面,加过量铁粉,铁和硫酸铜反应生成硫酸亚铁和铜,铁和稀硫酸反应生成硫酸亚铁和氢气。
(4)在实验过程中,双氧水会与![]() 反应生成
反应生成![]() 和水,水做溶剂,不会影响产物。
和水,水做溶剂,不会影响产物。
(1)操作1分离固体和液体,它的名称是过滤。
(2)在氧化铜锌矿中加入过量稀硫酸,充分反应后氧化铜和硫酸反应生成硫酸铜,氧化锌和硫酸反应生成硫酸锌,溶液中的溶质为ZnSO4、CuSO4、H2SO4。
(3)金属活动性顺序中,铁在锌后面,在氢元素、铜的前面,加过量铁粉,铁和硫酸铜反应生成硫酸亚铁和铜,铁和稀硫酸反应生成硫酸亚铁和氢气,发生反应的化学方程式为Fe+CuSO4=FeSO4+Cu、Fe+H2SO4=FeSO4+H2↑。
(4)在实验过程中,双氧水会与![]() 反应生成
反应生成![]() 和水,水做溶剂,不会影响产物,选用双氧水的优点是最后的产物是水,不引入新的杂质。
和水,水做溶剂,不会影响产物,选用双氧水的优点是最后的产物是水,不引入新的杂质。

 阅读快车系列答案
阅读快车系列答案【题目】金属材料一直被广泛的应用着.
(1)铝制品耐腐蚀,其原因是_____(用化学方程式表示)
(2)波尔多液是由硫酸铜、生石灰加水配制而成,铁制容器不能用来配制波尔多液的原因是_____(用化学方程式表示).
(3)科学家发现了一种新金属,它的一些性质如表所示,这种金属的表面由一层氧化物保护层.
熔点 | 密度 | 导电性 | 导热性 | 强度 | 抗腐蚀性 |
2500℃ | 3g/cm3 | 良好 | 良好 | 与钢相似 | 优异 |
这种金属可能的用途是_____(填一种即可).
(4)用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是_____t(计算结果保留到0.1)