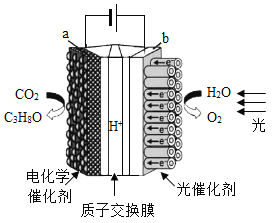
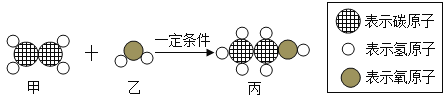
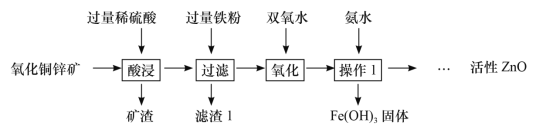
题目内容
【题目】金属材料一直被广泛的应用着.
(1)铝制品耐腐蚀,其原因是_____(用化学方程式表示)
(2)波尔多液是由硫酸铜、生石灰加水配制而成,铁制容器不能用来配制波尔多液的原因是_____(用化学方程式表示).
(3)科学家发现了一种新金属,它的一些性质如表所示,这种金属的表面由一层氧化物保护层.
熔点 | 密度 | 导电性 | 导热性 | 强度 | 抗腐蚀性 |
2500℃ | 3g/cm3 | 良好 | 良好 | 与钢相似 | 优异 |
这种金属可能的用途是_____(填一种即可).
(4)用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是_____t(计算结果保留到0.1)
【答案】4Al+3O2═2Al2O3 Fe+CuSO4═FeSO4+Cu 用作导线 583.3
【解析】
(1)铝制品耐腐蚀,其原因是通常情况下,铝能和空气中的氧气反应生成氧化铝保护膜,反应的化学方程式为:4Al+3O2═2Al2O3;
(2)铁制容器不能用来配制波尔多液的原因是铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu;
(3)这种金属具有良好的导电性,可以用作导线,具有良好的导热性,可以用作炊具等;
(4)设理论上可以炼出含铁96%的生铁的质量为x,
根据题意有:1000t×80%×![]() ×100%=x×96%,x≈583.3t。
×100%=x×96%,x≈583.3t。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
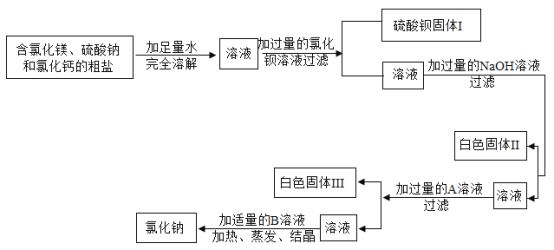
启东小题作业本系列答案【题目】有一包白色粉末样品,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜六种物质中的四种。化学兴趣小组为确定其组成设计并进行如下实验。
实验一:甲组同学进行定性探究
实验操作 | 实验现象 | 实验结论及分析 |
(1)取少量该样品于烧杯中,加入足量的水溶解、过滤 | 粉末部分溶解,得到白色滤渣和无色滤液 | 原样品中一定不含_____; |
(2)向滤液中滴加无色酚酞试液 | 溶液变红 | 滤液中存在_____性物质(填“酸”、“中”或“碱”) |
(3)向(2)中滴加足量稀盐酸 | _____ | 原样品中一定含有碳酸钠 |
实验二:乙组同学进行定量探究(如图)
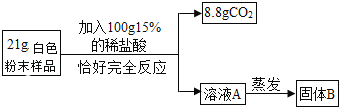
实验测得固体B中含15g氯元素,综合甲、乙两组同学的实验进行分析。
(1)乙组实验中一定发生的化学反应有碳酸钠与稀盐酸的反应和_____(用化学方程式表示)。
(2)该未知粉末的组成可能是_____。
【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如右图),为确认其中的溶质,同学们进行了如下的探究活动。请你参与到其中去,回答有关问题。
【进行猜想】猜想Ⅰ:该溶液的溶质是NaCl;
猜想Ⅱ:该溶液的溶质是NaOH;
猜想Ⅲ:该溶液的溶质是Na2CO3;
猜想IV:该溶液的溶质是NaHCO3.
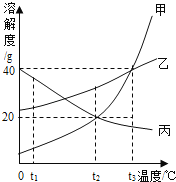
【查阅资料】常温下物质的相关信息如下表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,该溶液的溶质不是NaHCO3,因为常温下NaHCO3溶液溶质的质量分数最大是
(精确到01.%)。
【进行实验】
(1)测定溶液的pH大于7,该溶液的溶质不是 (填化学式)。
(2)同学们又进行了如下实验,实验过程如下:
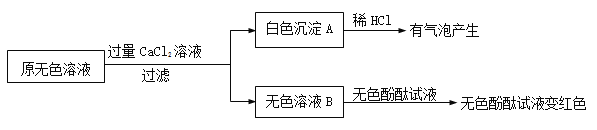
①产生白色沉淀的化学方程式是 。
②实验可以判断原无色溶液中含有的溶质有 。
【获得结论】
该瓶原来装的无色溶液的溶质是NaOH,并且 (填“没有”、“部分”或“全部”)变质。
【拓展】
提纯该无色溶液的步骤是:先向无色溶液中加入适量的 ,然后过滤。反应化学方程式是 。