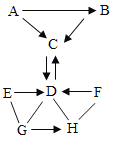
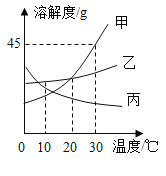
题目内容
【题目】向一定质量的MgSO4溶液中先后滴加100克Ba(OH)2、H2SO4溶液,过程中加入溶液的质量与产生沉淀的质量关系如图。下列说法正确的是
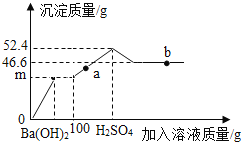
A.a点对应的溶液pH<7
B.b点溶液中的溶质只有1种
C.m=23.3
D.Ba(OH)2溶液溶质质量分数一定等于34.2%
【答案】D
【解析】
A、a点处于加入硫酸产生的沉淀不断增加的过程中,说明对应的溶液中含有氢氧化钡,溶液呈碱性,pH>7,选项A错误;
B、b点溶液中的溶质含有硫酸镁和硫酸2种,选项B错误;
C、由图像可知:氢氧化镁的质量为52.4g-46.6g=5.8g,MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓,则产生硫酸钡的质量为=![]() ,则m的质量为23.3g+5.8g=29.1g,选项C错误;
,则m的质量为23.3g+5.8g=29.1g,选项C错误;
D、加入硫酸后产生硫酸钡的质量=52.4g-29.1g=23.3g,则一共产生硫酸钡的质量为23.3g+23.3g=46.6g,则氢氧化钡的质量=![]() ,氢氧化钡溶液溶质质量分数=
,氢氧化钡溶液溶质质量分数=![]() 34.2%,选项D正确。故选D。
34.2%,选项D正确。故选D。

 阅读快车系列答案
阅读快车系列答案【题目】小组同学发现如图所示的两个试管中没有明显现象。为判断两支试管中是否发生了反应,小组同学进行了以下探究。
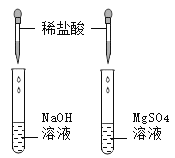
探究一.探究稀盐酸与氢氧化钠溶液是否发生了化学反应
[实验1]取少量氢氧化钠溶液于试管中,向其中滴加少量______溶液,然后再滴加足量的稀盐酸,观察到溶液颜色发生变化的情况是:先变红,然后_____。
[结论]稀盐酸和氢氧化钠溶液发生了反应。
探究二.探究稀盐酸和硫酸镁溶液是否发生了化学反应
小明决定通过探究试管②溶液中所含有的离子种类来判断反应是否发生。(将试管②的溶液分成两份)
[实验2]
实验 | 现象 | 结论 |
(1)测试管②中溶液的pH | pH<7 | 试管②中溶液含有氢离子 |
(2)向一份试管②的溶液中,加入足量的氢氧化钠溶液 | _________ | 试管②中溶液含有: _______ |
(3)向一份试管②的溶液中加入足量氯化钡溶液 | 产生白色沉淀 | 试管②中溶液含有: _____ |
(4)向(3)所得溶液中加入硝酸银溶液 | 产生白色沉淀 | 试管②中溶液含有氯离子 |
[结论]稀盐酸与硫酸镁溶液没有发生化学反应。
[交流与评价]小亮认为小明的实验不够严谨,其理由是______。为此小亮提出应将小明实验中某一步加入的试剂调整为另一种盐溶液,按照小亮的修改方案,最终得出“稀盐酸与硫酸镁溶液没有发生化学反应”的结论。小亮的修改方案是_________。