题目内容
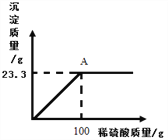
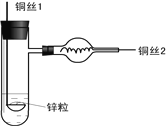
【题目】在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图所示。下列说法不正确的是(____)
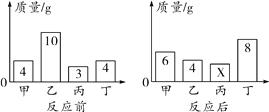
A. 该反应为分解反应
B. 丙可能为该反应的催化剂
C. 参加反应的乙与生成的丁的质量比为3∶2
D. 乙的相对分子质量是甲的3倍
【答案】D
【解析】根据质量守恒定律,反应后丙的质量为:4g+10g+3g+4g-(6g+4g+8g)=3g,故乙为反应物,甲、丁为生成物,丙可能为催化剂,该反应为分解反应;A、该反应为分解反应,故正确;B、丙可能为催化剂,故正确;C、参加反应的乙、丁质量比为:(10g-4g):(8g-4g)=3:2,故正确;D、生成甲、丁的质量比为:(6g-4g):(8g-4g)=1:2,由于未知反应的化学方程式中的化学计量数,故无法确定甲、丁的相对分子质量比,故选项说法错误。故选D。

 阅读快车系列答案
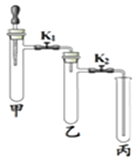
阅读快车系列答案【题目】利用表中装置进行下列实验。
实验装置 | 实验1 | 实验2 |
| ①甲试管中放入少量MnO2,滴管中放入过氧化氢溶液,乙、丙中分别放入一小块白磷依次加入适量80℃的水,白磷均不燃烧 ②打开K1、K2,将过氧化氢溶液滴入试管,观察到乙试管中白磷不燃烧,丙中白磷燃烧 ③一段时间后,丙中导管内液 面上升 | ①关闭K1,打开K2,甲试管中充满CO2,滴管中放入浓NaOH溶液;乙试管中放入适量铁粉,丙中放入约半试管稀盐酸 ②将浓NaOH溶液滴入甲试管中,一段时间后,打开K1 ③一段时间后,观察乙、丙试管中的现象 |
(1)实验1:甲中发生反应的化学方程式是_______________,对比乙和丙中的实验现象,本实验欲探究的燃烧条件是_____________;步骤③中“丙中导管内液面上升”的原因是________________。
(2)实验2:甲中发生反应的化学方程式为____________;步骤③乙中的现象是_____________;丙试管中的现象是_________。