题目内容
工业制取的粗盐(NaCl)中常混有MgCl2、CaCl2,欲分离提纯加以利用,实验过程如图:

(1)将粗盐溶于水,加入过量氢氧化钠将氯化镁转化为沉淀后过滤,再向滤出的沉淀中加入适量的 ,得到氯化镁,使氯化镁得以分离再利用;
(2)在滤液b中加入适量盐酸的目的是 ,如果滴加的稀盐酸过量,对最后得到的精盐的成分 影响(选填“有”或“没有”)

(1)将粗盐溶于水,加入过量氢氧化钠将氯化镁转化为沉淀后过滤,再向滤出的沉淀中加入适量的
(2)在滤液b中加入适量盐酸的目的是
考点:氯化钠与粗盐提纯,酸的化学性质,盐的化学性质
专题:常见的盐 化学肥料
分析:(1)氢氧化镁沉淀能与稀硫酸反应,生成氯化镁;
(2)盐酸能与氢氧化钠反应生成氯化钠,盐酸溶质氯化氢沸点低,稀盐酸过量,对最后得到的精盐的成分没有影响;
(2)盐酸能与氢氧化钠反应生成氯化钠,盐酸溶质氯化氢沸点低,稀盐酸过量,对最后得到的精盐的成分没有影响;
解答:解:(1)氢氧化镁沉淀能与稀硫酸反应,生成氯化镁;
(2)盐酸能与氢氧化钠反应生成氯化钠,故在滤液b中加入适量盐酸的目的是把氢氧化钠转化为氯化钠;盐酸溶质氯化氢沸点低,在蒸发过程中早已跑掉,故稀盐酸过量,对最后得到的精盐的成分没有影响;
答案:(1)稀盐酸;
(2)把氢氧化钠转化为氯化钠,没有;
(2)盐酸能与氢氧化钠反应生成氯化钠,故在滤液b中加入适量盐酸的目的是把氢氧化钠转化为氯化钠;盐酸溶质氯化氢沸点低,在蒸发过程中早已跑掉,故稀盐酸过量,对最后得到的精盐的成分没有影响;
答案:(1)稀盐酸;
(2)把氢氧化钠转化为氯化钠,没有;
点评:本题涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力并对课本知识能够牢固的掌握.

练习册系列答案
相关题目
下列图示实验操作中,正确的是( )
A、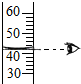 读出液体体积 |
B、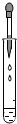 滴加液体 |
C、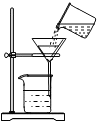 过滤 |
D、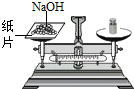 称量氢氧化钠 |
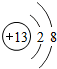 如图为某粒子的结构示意图,下列说法中错误的是
如图为某粒子的结构示意图,下列说法中错误的是