题目内容
【题目】(1)用化学符号表示:
①2个镁离子______________;
②氧化铁中+3价的铁元素_________;
③保持氨气化学性质的最小粒子 ___________;
④天然气的主要成分______。
(2)从下列物质中选择合适的物质,并将序号填在横线上:
A小苏打; B熟石灰; C明矾; D氯化钠。
①可用于净水的是_______;
②常用于改良酸性土壤的是______;
③腌制鱼肉等常用的调味品 _________;
④治疗胃酸过多_________。
(3)完成下列变化的化学方程式
①“曾青(硫酸铜)得铁则化铜”:________ ;
②氢气在空气中燃烧:___________ ;
③实验室加热高锰酸钾制氧气:___________ ;
④稀硫酸与氢氧化钠中和:____________。
【答案】![]()
![]()
![]()
![]() C B D A
C B D A ![]()
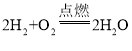
![]()
![]()
【解析】
(1)①2个镁离子:![]() ;
;
②氧化铁中+3价的铁元素:![]() ;
;
③保持氨气化学性质的最小粒子是氨气分子:![]() ;
;
④天然气的主要成分是甲烷:![]() 。
。
(2)①可用于净水的是:C明矾;
②常用于改良酸性土壤的是:B熟石灰;
③腌制鱼肉等常用的调味品是:D氯化钠;
④治疗胃酸过多的是:A小苏打。
(3)①“曾青(硫酸铜)得铁则化铜”为硫酸铜与铁反应生成铜和硫酸亚铁:![]() ;
;
②氢气在空气中燃烧生成水: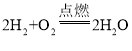 ;
;
③实验室加热高锰酸钾制氧气同时生成锰酸钾和二氧化锰:![]() ;
;
④稀硫酸与氢氧化钠中和,生成硫酸钠和水:![]() 。
。

练习册系列答案
相关题目