题目内容
已知,在水溶液中,乙醇(C2H5OH)不发生电离;溴化氢(HBr)电离产生氢离子(H+)和溴离子(Br-);氢氧化钠电离产生钠离子和氢氧根离子.请回答下列问题:
(1)根据这三种溶液的组成推断,医用酒精(含乙醇75%的水溶液)显______性,溴化氢的水溶液显______性.
(2)写出上述物质之间发生中和反应的化学方程式______.
(3)氢氧化钠溶液中存在的微粒有(用化学符号表示)______.
解:(1)由于酒精在水溶液中不发生电离,在它的溶液中也就没有氢离子或者是氢氧根离子,所以酒精溶液既不显酸性也不显碱性;而溴化氢能发生电离产生氢离子,因此它的水溶液呈酸性,故答案为:中,酸
(2)由于溴化氢电离时生成的阳离子只有氢离子,说明它是酸,而氢氧化钠是碱,故它们发生的反应是中和反应,故答案为:HBr+NaOH=NaBr+H2O
(3)氢氧化钠溶液是氢氧化钠的水溶液,故答案为:H2O、Na+、OH-
分析:有的溶液显酸性或碱性是因为这些溶液中含有氢离子或氢氧根离子,只有酸和碱发生的反应才是中和反应.
点评:本题难度不是很大,主要考查了有关酸的化学性质及中和反应的应用,培养学生的理解能力和分析能力.
(2)由于溴化氢电离时生成的阳离子只有氢离子,说明它是酸,而氢氧化钠是碱,故它们发生的反应是中和反应,故答案为:HBr+NaOH=NaBr+H2O
(3)氢氧化钠溶液是氢氧化钠的水溶液,故答案为:H2O、Na+、OH-
分析:有的溶液显酸性或碱性是因为这些溶液中含有氢离子或氢氧根离子,只有酸和碱发生的反应才是中和反应.
点评:本题难度不是很大,主要考查了有关酸的化学性质及中和反应的应用,培养学生的理解能力和分析能力.

练习册系列答案
相关题目
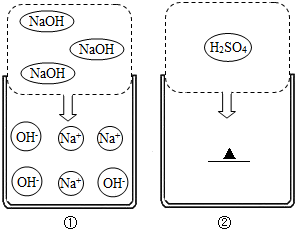
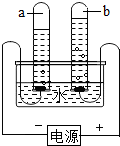
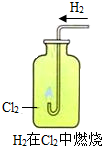
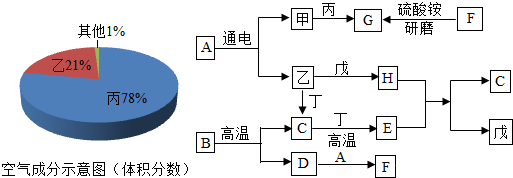
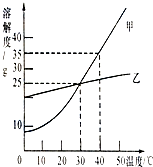 如图所示,填空:
如图所示,填空: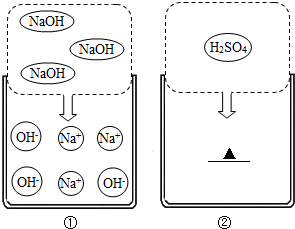
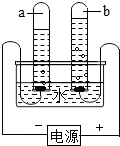
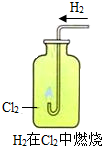
 2HCl.
2HCl.
 2HCl.
2HCl.