题目内容
实验中学甲乙两组同学开展了下列研究性学习活动.(一)、小组同学试验了氢氧化钠溶液、氯化钠溶液、稀硫酸、蒸馏水、乙醇的导电性试验.实验结果表明:乙醇不导电,蒸馏水几乎不导电,而氢氧化钠溶液、氯化钠溶液、稀硫酸却能导电.
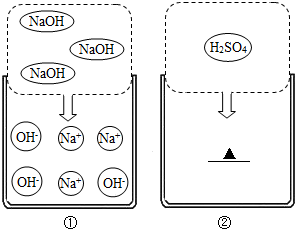
如图①是氢氧化钠在水溶液中的解离示意图.
(1)以氢氧化钠溶液为例,说明其导电的原因
(2)试在如图②画出硫酸在水溶液中的离子(用离子符号表示)
于是他们联想到老师在电解水实验时,强调为增强水的导电性,需向蒸馏水加入了某些物质.因此他们找来了:氯化钠、硫酸、氢氧化钠、碳酸钙、胆矾.
(二)、(1)甲、乙两组同学向蒸馏水中分别加入某些物质,都形成无色透明溶液,小张同学推测:都没有加入碳酸钙、胆矾,其理由
(2)两组同学又测定溶液的pH,测定方法是
(3)甲组同学用如图装置进行电解水实验,检验试管b中产生的气体的操作方法是
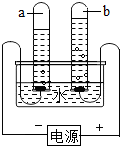
(4)试验完成后,甲组同学用试管取水槽内溶液适量,滴加硫酸铜溶液,产生蓝色沉淀,写出化学方程式
(三)、乙组同学也用上述相同的装置来电解某物质的水溶液,在试管b中产生黄绿色的气体,这是怎么回事呢?同学们一起向老师请教,知道了试管a是氢气,试管b中是氯气(Cl2).(至于什么原因,同学们将在今后学习中进一步研究)
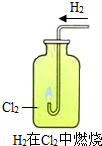
(1)在教师的指导下,查找资料,发现氢气在氯气中可以燃烧,化学方程式表示为H2+Cl2
| ||
试回答:①在试验氢气在氯气中燃烧之前,必须先检验氢气的
②实验中可以观察到氢气燃烧,发出苍白色的火焰,同时瓶口有
(2)比较氢气在空气中和在氯气中的燃烧,可以得出结论:
燃烧
(3)现在一密闭容器中盛有H2、O2、Cl2的混合气体,已知其分子数之比为11:5:1,用电火花点燃,使其充分反应,冷却后所得溶液的质量分数为
分析:(一)、溶液导电是因为溶液中含有自由移动的离子,硫酸在水溶液中会生成氢离子与硫酸根离子.
(二)、(1)溶于水是无色则一定不是胆矾与碳酸钙因为胆矾溶于水是蓝色,而碳酸钙不溶于水.
(2)利用PH试纸的检验方法检验溶液的酸碱性,由于PH大于7所以溶液呈碱性,是氢氧化钠的溶液,它能与硫酸铜反应生成氢氧化铜的蓝色沉淀.
(3)由于此处产生氧气故可用带火星木条进行检验即可.
(三)(1)凡是可燃性气体在加热前都应检验纯度,由生成的氯化氢气体极易与水结合成盐酸的白雾.
(2)燃烧不一定要氧气参加.
(3)利用H2、O2、Cl2的混合气体,分子数之比为11:5:1,求出所得水分子与氯化氢分子的个数进行求解.
(二)、(1)溶于水是无色则一定不是胆矾与碳酸钙因为胆矾溶于水是蓝色,而碳酸钙不溶于水.
(2)利用PH试纸的检验方法检验溶液的酸碱性,由于PH大于7所以溶液呈碱性,是氢氧化钠的溶液,它能与硫酸铜反应生成氢氧化铜的蓝色沉淀.
(3)由于此处产生氧气故可用带火星木条进行检验即可.
(三)(1)凡是可燃性气体在加热前都应检验纯度,由生成的氯化氢气体极易与水结合成盐酸的白雾.
(2)燃烧不一定要氧气参加.
(3)利用H2、O2、Cl2的混合气体,分子数之比为11:5:1,求出所得水分子与氯化氢分子的个数进行求解.
解答:解:(一)、溶液导电是因为溶液中溶质的电离使溶液中存在自由移动的离子,硫酸在水溶液中会生成氢离子与硫酸根离子.
故答案为:溶液中有自由移动的离子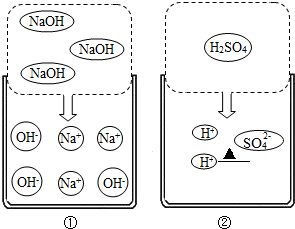
(二)、(1)由于溶于水时溶液无色,则一定不是胆矾与碳酸钙溶于水中,因为胆矾溶于水是蓝色,而碳酸钙不溶于水.
故答案为:碳酸钙不溶于水,而胆矾溶于溶液呈蓝色
(2)利用PH试纸的检验方法是取样品实验,检验溶液的酸碱性,由于甲PH大于7所以溶液呈碱性,是氢氧化钠的溶液,而乙的PH等于7是氯化钠的溶液,其阳离子应为钠离子,它能与硫酸铜反应生成氢氧化铜的蓝色沉淀.
故答案为:把pH试纸放于玻璃片上,用玻璃棒蘸取待测液体滴到pH试纸上,再与比色卡对照;NaOH;Na+
(3)b管接的是正极生成的是氧气,用带火星的木条检验即可,氢氧化钠能与硫酸铜反应生成氢氧化铜的蓝色沉淀.
故答案为:用带火星木条插入气体中,若木条能复燃,证明其是氧气;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(三)、(1)凡是可燃性气体在加热前都应检验纯度,由生成的氯化氢气体极易吸收水结合成盐酸的白雾.
故答案为:①纯度;②白雾.
(2)此反应是燃烧,没有氧气参与.
故答案为:燃烧不一定要氧气参加.
(3)利用H2、O2、Cl2的混合气体,分子数之比为11:5:1,求出所得水分子与氯化氢分子的个数进行求解.
生成水时氢气与氧气分子个数比是2:1,生成氯化氢时分子个数比是1:1,则可看成最终会生成2个氯化氢分子10个水分子,于是其溶质质量分数为:
×100%=28.9%
故答案为:溶液中有自由移动的离子

(二)、(1)由于溶于水时溶液无色,则一定不是胆矾与碳酸钙溶于水中,因为胆矾溶于水是蓝色,而碳酸钙不溶于水.
故答案为:碳酸钙不溶于水,而胆矾溶于溶液呈蓝色
(2)利用PH试纸的检验方法是取样品实验,检验溶液的酸碱性,由于甲PH大于7所以溶液呈碱性,是氢氧化钠的溶液,而乙的PH等于7是氯化钠的溶液,其阳离子应为钠离子,它能与硫酸铜反应生成氢氧化铜的蓝色沉淀.
故答案为:把pH试纸放于玻璃片上,用玻璃棒蘸取待测液体滴到pH试纸上,再与比色卡对照;NaOH;Na+
(3)b管接的是正极生成的是氧气,用带火星的木条检验即可,氢氧化钠能与硫酸铜反应生成氢氧化铜的蓝色沉淀.
故答案为:用带火星木条插入气体中,若木条能复燃,证明其是氧气;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(三)、(1)凡是可燃性气体在加热前都应检验纯度,由生成的氯化氢气体极易吸收水结合成盐酸的白雾.
故答案为:①纯度;②白雾.
(2)此反应是燃烧,没有氧气参与.
故答案为:燃烧不一定要氧气参加.
(3)利用H2、O2、Cl2的混合气体,分子数之比为11:5:1,求出所得水分子与氯化氢分子的个数进行求解.
生成水时氢气与氧气分子个数比是2:1,生成氯化氢时分子个数比是1:1,则可看成最终会生成2个氯化氢分子10个水分子,于是其溶质质量分数为:
| 2×36.5 |
| 2×36.5+180 |
点评:此题是一道综合题,解题的关键是分清题意结合信息对内容进行分析,主要是利用溶质的电离知识及溶液中各物质的反应及判断解决问题,属综合性较强的题目.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
蕲春实验中学化学课外活动小组选择如下相应的装置对某有机物燃烧产物进行探究,并对该有机物成分进行测定:

[提出假设]根据质量守恒定律,可得出该有机物燃烧产物可能为①CO2、H2O;②H2O、CO;③CO2、H2O、CO.
[设计实验]
(1)余成林同学选择D、E分别验证假设①,如观察到E中______现象,则证明有H2O,如观察到D中______现象,则证明有CO2;
(2)翁京京同学选择装置A、C、D、E按照E D C A 的连接顺序一次性来验证假设②,实验时发现E中无水CuSO4变蓝,D中澄清石灰水变浑浊,A中黑色CuO变成光亮红色,则假设②是否成立______,得出这个结论的理由是:______.
(3)汪俊同学同样按照E D C A D的连接顺序来验证假设③,如该假设成立,则丙同学应应观察到______现象,那么该实验装置还有何不足:______.
(4)现假设该有机物燃烧产物为CO2、H2O,有甲、乙两组同学选择B、C装置分别两种方法测定它的组成,得出两组数据(连接顺序与数据如下表)
你认为甲、乙两小组的两种方法哪种正确?______,理由是:______.请你选择、计算得出有机物各元素的质量比______.

[提出假设]根据质量守恒定律,可得出该有机物燃烧产物可能为①CO2、H2O;②H2O、CO;③CO2、H2O、CO.
[设计实验]
(1)余成林同学选择D、E分别验证假设①,如观察到E中______现象,则证明有H2O,如观察到D中______现象,则证明有CO2;
(2)翁京京同学选择装置A、C、D、E按照E D C A 的连接顺序一次性来验证假设②,实验时发现E中无水CuSO4变蓝,D中澄清石灰水变浑浊,A中黑色CuO变成光亮红色,则假设②是否成立______,得出这个结论的理由是:______.
(3)汪俊同学同样按照E D C A D的连接顺序来验证假设③,如该假设成立,则丙同学应应观察到______现象,那么该实验装置还有何不足:______.
(4)现假设该有机物燃烧产物为CO2、H2O,有甲、乙两组同学选择B、C装置分别两种方法测定它的组成,得出两组数据(连接顺序与数据如下表)
| 有机物 的质量 | 装置的连接顺序 | 装置的质量 实验前 实验后 | |
| 甲组 | 1.6克 | C接B | B 200克 B 202.3克 C 200克 C 201.7克 |
| 乙组 | 1.6克 | B接C | B 200克 B 201.8克 C 200克 C 202.2克 |




 2HCl.
2HCl.


 2HCl.
2HCl.