题目内容
【题目】实验是学习和研究化学的重要方法,回答问题:
(1)下图装置可测定空气中氧气的含量,实验过程中需反复推拉注射器的活塞,目的是使______(填写物质的化学式)完全反应。
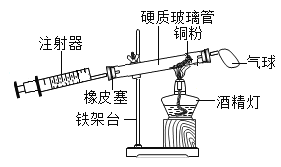
(2)实验室制氧气时常选择下图装置,其中使用分液漏斗和长颈漏斗相比,优势在于________(填写序号)。
![]()
A.可以增加生成物的质量 B可以控制反应的速率 C操作简单,节约能源D可以控制反应随时发生或停止
(3)进行上述的实验时,加药品前要先检验装置的____________。
(4)若要回收用过氧化氢溶液与二氧化锰反应后溶液中剩余的固体,需要用到的玻璃仪器有烧杯、玻璃棒和_________:要证明二氧化锰是该反应的催化剂,需证明反应前后二氢化锰的__________________不变。
【答案】O2 B 气密性 漏斗 质量和化学性质
【解析】
(1)根据反应的原理,氧气反应越充分,实验结果越准确进行分析;
(2)根据仪器的用途来分析;
(3)根据保证实验结果的准确性来分析;
(4)根据分离混合物的方法和催化剂的概念来分析。
(1)铜与氧气在加热的条件下反应生成氧化铜。实验过程中,轮流推动两个注射器的目的是使装置中的O2充分反应,使实验结果更准确;
(2)实验室制氧气时常选择图中装置,分液漏斗能控制液体的滴加速度,控制反应的速度,使用分液漏斗优势在于可以控制反应的速率,故选B;
(3)进行上述的实验时,为防止装置漏气,加药品前要先检验装置的气密性;
(4)二氧化锰是一种难溶水的固体粉末,若要将其从液体中分离出来需要采用过滤的方法,需要用到的玻璃仪器有烧杯、玻璃棒和漏斗;要证明二氧化锰是该反应的催化剂,需证明反应前后二氧化锰的质量和化学性质不变。

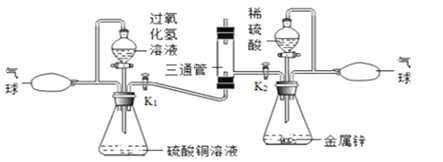
【题目】定量研究对于化学科学发展有重大作用,因此我们应该掌握好有关质量守恒定律的相关知识。
(1)下图A、B、C三个实验用于验证质量守恒定律,
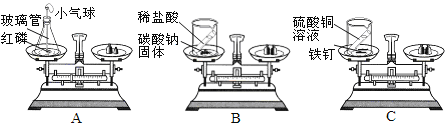
图A中小气球的作用是_________,图C中反应的化学方程式为__________
(2)分别实验后,发现图B不能达到实验目的,原因是___________。
(3)在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | A | B | C | D |
反应前质量/g | 2 | 24.5 | 4 | 8 |
反应后质量/g | 16.9 | 0 | 13.6 | X |
X的值为______________ ,容器内发生反应的基本类型是_________。
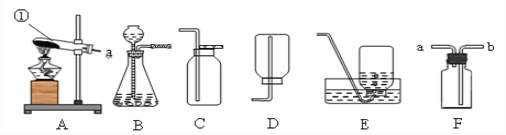
【题目】根据下图回答问题。
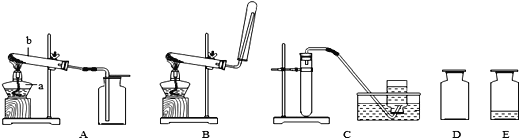
(1)写出标有序号仪器的名称:a_____
(2)实验室用高锰酸钾制取氧气应选用的装置是_______(填装置下方的字母序号),你认为该装置中还缺少_____,该化学反应的文字表达式为_________
(3)若用C装置制取氧气发生化学反应的文字表达式__________,反应的基本类型为_______。
(4)图中D、E是收集到的两瓶氧气,若进行硫磺在氧气中燃烧的实验,应选用的一瓶是_____(填装置下方的字母序号)。
(5)氨气是一种极易溶于水且密度比空气小的气体,实验室常用加热氯化铵和氢氧化钙固体混合物来制取氨气。则实验室制取氨气应选择的装置是_______(填序号)。收集氨气只能选用向下排空气法,其原因是_____。
(6)下表是研究性学习小组研究影响过氧化氢分解速率的因素时采集的一组数据:用10mL过氧化氢溶液制取150mL氧气所需的时间(秒)
浓度 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360s | 480s | 540s | 720s |
MnO2催化剂、不加热 | 40s | 60s | 120s | 180s |
MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
① 该研究小组在设计方案时,考虑了_______、_______、_______等因素对过氧化氢分解速率的影响.
② 从上表的数据中,你能得出什么结论?(填两点)
_________。、__________。