题目内容
某化工厂排放的废水中只含有盐酸和MgCl2两种物质.小明同学向采集来的62.8g废水样品中,慢慢加入20%的NaOH溶液至恰好完全反应时,消耗NaOH溶液60g.将生成的沉淀物过滤出,经水洗、干燥后称重为5.8g.
(1)写出向废水中加入NaOH溶液发生反应的化学方程式:______;
(2)请求出上述废水样品完全反应后的溶液里溶质的质量分数(要有计算过程)
解:(1)盐酸与氢氧化钠反应的反应物是盐酸和氢氧化钠,生成物是氯化钠和水;氯化镁与氢氧化钠反应的反应物是氯化镁和氢氧化钠,生成物是氯化钠和氢氧化镁,氢氧化镁要标上沉淀符号,用观察法配平,所以方程式分别为:HCl+NaOH═NaCl+H2O、MgCl2+2NaOH═2NaCl+Mg(OH)2↓
(2)解:参加反应的氢氧化钠的质量为60g×20%=12g
根据方程式可知溶质都是氯化钠,并且消耗氢氧化钠与生成的氯化钠的分子个数比都是1:1,所以根据关系式法可求出氯化钠,设氯化钠质量为X:
HCl+NaOH═NaCl+H2O
40 58.5
12g X
根据: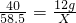 解得X=17.55g
解得X=17.55g
反应后总溶液质量为:62.8g+60g-5.8g=117g所以废水样品完全反应后的溶液里溶质的质量分数为: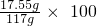 %=15%.
%=15%.
故答案为:(1)HCl+NaOH═NaCl+H2O、MgCl2+2NaOH═2NaCl+Mg(OH)2↓;(2)15%.
分析:(1)根据方程式的书写方法写出方程式;(2)根据沉淀的质量计算出氢氧化钠与氯化镁反应生成的氯化钠的质量,用消耗的总氢氧化钠的质量减去与氯化镁反应消耗的氢氧化钠的质量就是与盐酸反应的氢氧化钠的质量,再根据这一氢氧化钠的质量计算出与盐酸反应生成的氯化钠的质量,将两个方程式计算的氯化钠加在一块,除以溶液的总质量.
点评:本题容易出错的地方是生成物中溶质有两部分,必须加在一块计算,溶液质量计算时别忘了减去沉淀的质量.
(2)解:参加反应的氢氧化钠的质量为60g×20%=12g
根据方程式可知溶质都是氯化钠,并且消耗氢氧化钠与生成的氯化钠的分子个数比都是1:1,所以根据关系式法可求出氯化钠,设氯化钠质量为X:
HCl+NaOH═NaCl+H2O
40 58.5
12g X
根据:
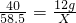 解得X=17.55g
解得X=17.55g反应后总溶液质量为:62.8g+60g-5.8g=117g所以废水样品完全反应后的溶液里溶质的质量分数为:
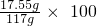 %=15%.
%=15%.故答案为:(1)HCl+NaOH═NaCl+H2O、MgCl2+2NaOH═2NaCl+Mg(OH)2↓;(2)15%.
分析:(1)根据方程式的书写方法写出方程式;(2)根据沉淀的质量计算出氢氧化钠与氯化镁反应生成的氯化钠的质量,用消耗的总氢氧化钠的质量减去与氯化镁反应消耗的氢氧化钠的质量就是与盐酸反应的氢氧化钠的质量,再根据这一氢氧化钠的质量计算出与盐酸反应生成的氯化钠的质量,将两个方程式计算的氯化钠加在一块,除以溶液的总质量.
点评:本题容易出错的地方是生成物中溶质有两部分,必须加在一块计算,溶液质量计算时别忘了减去沉淀的质量.

练习册系列答案
相关题目
我市某化工厂排放的废水中含有HCl,化验员小李对本厂排放的废水中HCl的质量分数进行测定:将20mL废水(假定其密度为1g/cm3)样品置于锥形瓶中,用质量分数为1%的氢氧化钠溶液进行中和,共用去氢氧化钠溶液8g(假设废水中不含其他能与氢氧化钠溶液反应的物质).
(1)计算该废水中含HCl的质量分数.
(2)该厂每天产生废水100吨,若直接排放将对环境造成污染,必须进行无害化处理后才能进行排放,现准备用氢氧化钙粉末或质量分数为10%的氢氧化钠溶液进行中和.有关数据如下表所示:
| 物质 | 物质(或溶质)的相对分子质量 | 市场参考价(元/吨) |
| 氢氧化钙粉末 | 74 | 200 |
| 10%的氢氧化钠溶液 | 40 | 100 |