题目内容
 金属是一类重要的材料,人类的日常生产和生活都离不开金属.
金属是一类重要的材料,人类的日常生产和生活都离不开金属.(1)金属元素在自然界分布很广,地壳中含量最多的金属元素是
铝
铝
(填名称).大多数金属元素以化合物存在于自然界.常见的铁矿有磁铁矿
磁铁矿
,其主要成分为Fe3O4
Fe3O4
.(2)冶炼金属的方法很多,试写出下列冶炼金属的主要化学反应方程式:
Ⅰ.氢气在加热条件下与氧化铜反应
H2+CuO
H2O+Cu
| ||
H2+CuO
H2O+Cu
;
| ||
Ⅱ.一氧化碳通过灼热的四氧化三铁
4CO+Fe3O4
4CO2+3Fe
| ||
4CO+Fe3O4
4CO2+3Fe
;
| ||
Ⅲ.电解氧化铝
2Al2O3
4Al+3O2↑
| ||
2Al2O3
4Al+3O2↑
;
| ||
Ⅳ.西汉湿法炼铜
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
;其中属于置换反反应的是
Ⅰ、Ⅳ
Ⅰ、Ⅳ
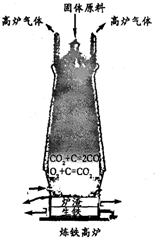
(填序号).(3)某地根据当地资源特点将石灰石的开采、加工和高炉炼铁建在一起形成联产.
①炼铁的固体原料有铁矿石、焦炭和
石灰石
石灰石
.请写出炼铁过程中CO和Fe2O3反应的化学方程式:3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
②高炉炼铁排放的废气中含有大量的高温一氧化碳,可作为能源用来煅烧石灰石.请写出煅烧石灰石的化学方程式:
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
.
| ||
③此联产方式的主要优点是:
降低成本
降低成本
(答出一点即可).分析:(1)根据地壳中含量最多的金属元素是铝元素以及常见的铁矿有赤铁矿、磁铁矿进行解答;
(2)氢气和氧化铜反应生成铜和水;一氧化碳通过灼热的四氧化三铁生成铁和二氧化碳;电解氧化铝生成铝和氧气;铁和硫酸铜反应生成铜和硫酸亚铁;置换反应是一种单质和化合物反应生成另外的单质和化合物的反应;
(3)炼铁的固体原料有铁矿石、焦炭和石灰石;CO和Fe2O3反应生成铁和二氧化碳;煅烧石灰石生成氧化钙和二氧化碳;
(2)氢气和氧化铜反应生成铜和水;一氧化碳通过灼热的四氧化三铁生成铁和二氧化碳;电解氧化铝生成铝和氧气;铁和硫酸铜反应生成铜和硫酸亚铁;置换反应是一种单质和化合物反应生成另外的单质和化合物的反应;
(3)炼铁的固体原料有铁矿石、焦炭和石灰石;CO和Fe2O3反应生成铁和二氧化碳;煅烧石灰石生成氧化钙和二氧化碳;
解答:解:(1)地壳中含量最多的金属元素是铝元素;常见的铁矿有赤铁矿,其主要成分为Fe2O3、磁铁矿其主要成分Fe3O4;
(2)Ⅰ氢气和氧化铜反应生成铜和水,化学反应方程式:H2+CuO
H2O+Cu;Ⅱ一氧化碳通过灼热的四氧化三铁生成铁和二氧化碳,化学反应方程式:4CO+Fe3O4
4CO2+3Fe;Ⅲ电解氧化铝生成铝和氧气,化学反应方程式:2Al2O3
4Al+3O2↑;Ⅳ铁和硫酸铜反应生成铜和硫酸亚铁,化学反应方程式:Fe+CuSO4=FeSO4+Cu;ⅠⅣ一种单质和化合物反应生成另外的单质和化合物的反应,所以Ⅰ、Ⅳ属于置换反应;
(3)①炼铁的固体原料有铁矿石、焦炭和石灰石;②CO和Fe2O3反应生成铁和二氧化碳,化学反应方程式:3CO+Fe2O3
2Fe+3CO2 ;
②煅烧石灰石生成氧化钙和二氧化碳,化学反应方程式:CaCO3
CaO+CO2↑;
③此联产方式的主要优点是:降低成本.
故答案为:(1)铝; 磁铁矿; Fe3O4; (2)H2+CuO
H2O+Cu;
4CO+Fe3O4
4CO2+3Fe; 2Al2O3
4Al+3O2↑; Fe+CuSO4=FeSO4+Cu;Ⅰ、Ⅳ;
(3)①石灰石; 3CO+Fe2O3
2Fe+3CO2;②CaCO3
CaO+CO2↑; ③降低成本.
(2)Ⅰ氢气和氧化铜反应生成铜和水,化学反应方程式:H2+CuO
| ||
| ||
| ||
(3)①炼铁的固体原料有铁矿石、焦炭和石灰石;②CO和Fe2O3反应生成铁和二氧化碳,化学反应方程式:3CO+Fe2O3
| ||
②煅烧石灰石生成氧化钙和二氧化碳,化学反应方程式:CaCO3
| ||
③此联产方式的主要优点是:降低成本.
故答案为:(1)铝; 磁铁矿; Fe3O4; (2)H2+CuO
| ||
4CO+Fe3O4
| ||
| ||
(3)①石灰石; 3CO+Fe2O3
| ||
| ||
点评:本题从金属的利用,冶炼,锈蚀及保存等方面全面考查了金属的性质,是一道不错的试题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


 金属是一类重要的材料,人类的生活和生产都离不开金属.
金属是一类重要的材料,人类的生活和生产都离不开金属.