题目内容
金属是一类重要的材料,其应用十分广泛.
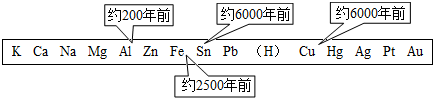
(1)铝的利用比铜和铁晚.金属大规模开发和利用的先后顺序与下列
甲.金属的活动性 乙.金属的导电性 丙.金属在地壳中的含量
(2)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如钢比纯铁硬度
(3)我国早在春秋战国时期就开始炼铁、应用金属铁.请你用化学方程式表示用一氧化碳还原氧化铁的化学反应原理
(4)小思实验操作考试的题目是探究金属的化学性质5,内容包括:铜在空气中灼烧_、锌与稀硫酸反应、铝丝与硫酸铜溶液反应.如图是他实验操作考试中的部分情景.
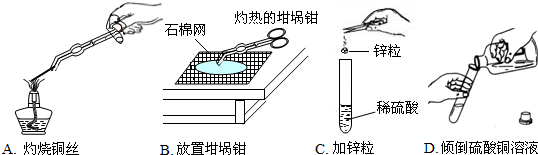
①图中有一处错误的操作,该操作是
②他将铝丝插入到硫酸铜溶液中,未出现任何现象,其原因是
(5)印刷铜制电路版的“腐蚀液“为FeCl3溶液.已知铜、铁均能与FeCl3溶液反应,反应的化学方程式分别为:①Cu+2FeCl3═FeCl2+CuCl2,②Fe+2FeCl3═3X.
①写出化学方程式②中x的化学式:
②现有一包铜、铁的混合粉末加入到盛有一定量FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体剩余,那么烧杯内的固体中一定含有的物质是
(1)铝的利用比铜和铁晚.金属大规模开发和利用的先后顺序与下列
甲
甲
有关(填序号).甲.金属的活动性 乙.金属的导电性 丙.金属在地壳中的含量
(2)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如钢比纯铁硬度
大
大
(填“大”或“小”).(3)我国早在春秋战国时期就开始炼铁、应用金属铁.请你用化学方程式表示用一氧化碳还原氧化铁的化学反应原理
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(4)小思实验操作考试的题目是探究金属的化学性质5,内容包括:铜在空气中灼烧_、锌与稀硫酸反应、铝丝与硫酸铜溶液反应.如图是他实验操作考试中的部分情景.

①图中有一处错误的操作,该操作是
C
C
(填序号);②他将铝丝插入到硫酸铜溶液中,未出现任何现象,其原因是
铝丝表面的氧化膜未处理
铝丝表面的氧化膜未处理
.(5)印刷铜制电路版的“腐蚀液“为FeCl3溶液.已知铜、铁均能与FeCl3溶液反应,反应的化学方程式分别为:①Cu+2FeCl3═FeCl2+CuCl2,②Fe+2FeCl3═3X.
①写出化学方程式②中x的化学式:
FeCl2
FeCl2
.②现有一包铜、铁的混合粉末加入到盛有一定量FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体剩余,那么烧杯内的固体中一定含有的物质是
Cu
Cu
(填化学式).分析:(1)从人类大规模开发、利用金属的年限可以看出,越活泼的金属,开发利用的越晚,说明主要和金属的活动性有关.
(2)根据合金的性质进行分析.
(3)根据反应物和生成物及其质量守恒定律可以书写化学方程式;
(4)依据实验基本操作对错误操作进行查找分析;从金属铝存在氧化膜分析不出现现象的原因;
(5)根据质量守恒定律化学反应前后原子种类、原子个数相等;在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
(2)根据合金的性质进行分析.
(3)根据反应物和生成物及其质量守恒定律可以书写化学方程式;
(4)依据实验基本操作对错误操作进行查找分析;从金属铝存在氧化膜分析不出现现象的原因;
(5)根据质量守恒定律化学反应前后原子种类、原子个数相等;在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答:解:(1)铝的活动性大于铜与铁,从人类大规模开发、利用金属限可以看出,越活泼的金属,开发利用的越晚,说明主要和金属的活动性有关.
(2)合金的硬度比纯金属要大,钢是铁的合金所以比纯铁硬度大的多,
(3)一氧化碳还原氧化铁的化学方程式为:Fe2O3+3CO
2Fe+3CO2;
(4)①分析铜在空气中灼烧、锌与稀硫酸反应、铝丝与硫酸铜溶液反应的操作可知,错误的操作为C,因为加锌粒,取用块状固体时,不能直接如图放入,将会砸裂试管底部;
②他将铝丝插入到硫酸铜溶液中,未出现任何现象,其原因是铝丝表面被氧化,氧化膜(Al2O3)不和硫酸铜反应.
(5)①根据质量守恒定律化学反应前后原子种类、原子个数相等可得X的化学式为:FeCl2 .
②将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,能发生的反应有①Cu+2FeCl3=2FeCl2+CuCl2,②Fe+2FeCl3=3FeCl2,③Fe+CuCl2═FeCl2+Cu,铜和铁都能与氯化铁反应生成氯化亚铁,故所得溶液中一定含有氯化亚铁,充分反应后仍有少量固体,根据反应的方程式可知一定含有铜,由于铁的量不确定,故可能含有铁,有铜存在,则不可能含有氯化铁;
故答案为:
(1)甲;
(2)大;
(3)Fe2O3+3CO
2Fe+3CO2;
(4)①C②铝丝表面的氧化膜未处理;
(5)FeCl2;Cu.
(2)合金的硬度比纯金属要大,钢是铁的合金所以比纯铁硬度大的多,
(3)一氧化碳还原氧化铁的化学方程式为:Fe2O3+3CO
| ||
(4)①分析铜在空气中灼烧、锌与稀硫酸反应、铝丝与硫酸铜溶液反应的操作可知,错误的操作为C,因为加锌粒,取用块状固体时,不能直接如图放入,将会砸裂试管底部;
②他将铝丝插入到硫酸铜溶液中,未出现任何现象,其原因是铝丝表面被氧化,氧化膜(Al2O3)不和硫酸铜反应.
(5)①根据质量守恒定律化学反应前后原子种类、原子个数相等可得X的化学式为:FeCl2 .
②将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,能发生的反应有①Cu+2FeCl3=2FeCl2+CuCl2,②Fe+2FeCl3=3FeCl2,③Fe+CuCl2═FeCl2+Cu,铜和铁都能与氯化铁反应生成氯化亚铁,故所得溶液中一定含有氯化亚铁,充分反应后仍有少量固体,根据反应的方程式可知一定含有铜,由于铁的量不确定,故可能含有铁,有铜存在,则不可能含有氯化铁;
故答案为:
(1)甲;
(2)大;
(3)Fe2O3+3CO
| ||
(4)①C②铝丝表面的氧化膜未处理;
(5)FeCl2;Cu.
点评:此题是一道与金属相关的考查题,解题的关键是对常见金属的性质的了解及掌握,重点是利用金属的活动性顺序解决相关的问题.

练习册系列答案
相关题目


 金属是一类重要的材料,人类的生活和生产都离不开金属.
金属是一类重要的材料,人类的生活和生产都离不开金属.