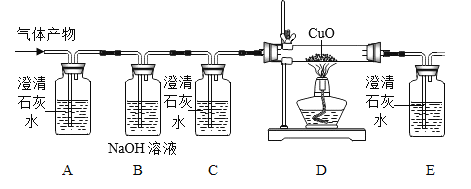
��Ŀ����
����Ŀ��п�̵�أ��׳Ƹɵ�أ���������Ӧ�ù㷺���乹����ͼ1��
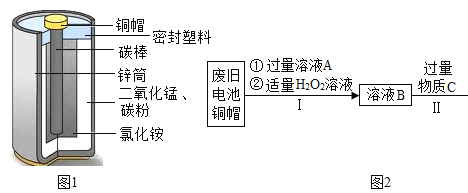
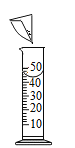
��1������ͼ1�жϣ����ڽ������ϵ���ͭñ��_________��
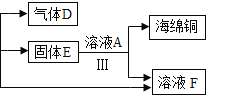
��2�����÷Ͼɵ��ͭñ����Cu��Zn����ȡ����ͭ��Cu�������õ�ZnSO4��Һ����Ҫ������ͼ2��
��֪��![]()
��д������II�����ɽ������ʵĻ�ѧ����ʽ��_____________________��
�ڹ��̢��м�����ҺA��ַ�Ӧ������е���Ҫ������_______��
������˵����ȷ����______�����ţ���
a����I��H2O2Ҳ�п��ֽܷ���������
b����E�ǻ����
c��ҺB�к���2��������
��3����һ�����������ۼ��뵽Zn(NO3)2��Cu(NO3)2��AgNO3�������ʵĻ����Һ�У���ַ�Ӧ����ˣ��õ���Һ�������������й�˵����ȷ����____������ĸ����
a����ҺΪ��ɫ����������һ��������������ͭ
b�������к�������ͭ����������Һ��һ������Zn2+�� Fe3+��NO3-
c����ҺΪdz��ɫ����������һ��������ͭ����
d�������м�ϡ���������ݲ���������Һ��һ����Zn2+�� Fe2+�� Cu2+,������Ag+
���𰸡�пͲ ![]() ���� ab A
���� ab A
��������
��1����ͼ1��֪��ͭñ��пͲ���ڽ������ϣ�
��2���Ͼɵ��ͭñ�к�ͭ��п����֪��![]() ������ҺAΪϡ���ᣬп��ϡ���ᷴӦ��������п��������
������ҺAΪϡ���ᣬп��ϡ���ᷴӦ��������п��������![]() ������ҺB�к�����п������ͭ������ϡ���ᣬ���ڸù���������ͭ���õ�����п��Һ���ʿɼ������п��п��������ͭ��Ӧ��������п��ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ����
������ҺB�к�����п������ͭ������ϡ���ᣬ���ڸù���������ͭ���õ�����п��Һ���ʿɼ������п��п��������ͭ��Ӧ��������п��ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ����![]() ��п���������ϡ���ᷴӦ��������п��������
��п���������ϡ���ᷴӦ��������п��������![]() �����Ƴ�CΪп��DΪ����������EΪͭ������п������ϡ���ᣬ������п��ϡ���ᷴӦ��������п����������FΪ����п��
�����Ƴ�CΪп��DΪ����������EΪͭ������п������ϡ���ᣬ������п��ϡ���ᷴӦ��������п����������FΪ����п��
�ٹʹ���II�����ɽ������ʵĻ�ѧ����ʽΪ��![]() ��
��
�ڹ��̢��м�����ҺA��ʹ������п��ϡ���ᷴӦ��������п��������ͭ����ϡ���ᷴӦ�����ˣ�ʵ�ֹ�Һ���룬�õ�ͭ���ʻ�����е���Ҫ�����ǣ����ˣ�
��a�����������ڼ��ȵ������¿ɷ�Ӧ����ˮ���������ҷ�Ӧ���ɵ�����ͭ����Ϊ������ʹ��������������ͭ�Ĵ��·ֽ�Ϊˮ���������������⣻
b�������Ϸ�����֪������EΪͭ��п��϶��ɵĻ����������⣻
c�������Ϸ�����֪����ҺB�к�����п������ͭ������ϡ���ᣬ����ҺB�к�3�������ӣ����������⡣
��ѡab��
��3����һ�����������ۼ��뵽Zn(NO3)2��Cu(NO3)2��AgNO3�������ʵĻ����Һ�У���������������Ӧ����������������������������ȫ��Ӧ������������ͭ��Ӧ��������������ͭ����������п����Ӧ��
a������ҺΪ��ɫ��˵������ͭδ��ȫ��Ӧ���������û��˲�������ͭ��Ҳ�����û��˲�����������ǡ�ú���������ȫ��Ӧ����������һ��������������ͭ���������⣻
b���������к�������ͭ��������������˵�����Ѿ�������ͭ����������ȫ�û�������Һ�к�������п����������������Zn2+�� Fe2+��NO3-�����������⣻
c������ҺΪdz��ɫ������ͭΪ��ɫ����ҺΪdz��ɫ��˵������ͭ��Һ�Ѿ���ȫ��Ӧ����������������ͭǡ����ȫ��Ӧ����ʱ������Ϊͭ������Ҳ����������������ʱ�����к���ͭ������������һ����ͭ���������ܺ��������������⣻
d���������м�ϡ���������ݲ�����˵�������в����������Ѿ���ȫ��Ӧ����������������Ӧ��������������������������һ����������Һ��һ����Zn2+�� Fe2+�������ܺ�����ͭǡ����ȫ��Ӧ����ʱ��Һ��ֻ��Zn2+�� Fe2+��Ҳ����ǡ�ú���������ȫ��Ӧ���û��˲�������ͭ����ʱ��Һ�к�Cu2+�� Zn2+�� Fe2+��Ҳ�����û��˲�������������ʱ��Һ�к�Zn2+�� Fe2+��Cu2+��Ag+������Һ��һ����Zn2+�� Fe2+��������Cu2+��Ag+�����������⡣
��ѡA��

 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д�����Ŀ��ʵ��С���ͬѧ�����ʵ��̽��ͭ�����������ֽ����Ļ��˳��:
[�ṩ��ҩƷ]��Ƭ��ͭƬ����Ƭ��ϡ���ᡢ�Ȼ�þ��Һ������п��Һ������ͭ��Һ����������Һ
[��������]��һ��:ͨ��4��ʵ�飬���Եó�����;
�ڶ���:ͨ��3��ʵ�飬���Եó�����;
������:ͨ��2��ʵ�飬���Եó�����;
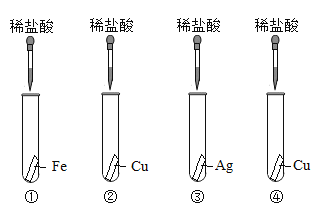
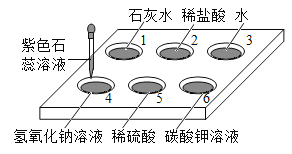
��ͼ�ǵ�һ��ͬѧ��Ʋ�������4��ʵ��
[ʵ�鷽��]
��С��ʵ����� | �йصĻ�ѧ����ʽ | ʵ����� |
��һ��:������ͼ��4��ʵ�飬�ڢܸ�ʵ���е�X��Һ��_______�� | �ڢ٢ڢ�ʵ����,ѡдһ��������Ӧ�Ļ�ѧ����ʽ________�� | ���ֽ����Ļ��˳����ǿ��������Ϊ_______�� |
�ڶ���:������ͼ�е�3��ʵ��,������_____(����ͼ��ʵ�����) | ||
������:����2��ʵ�飬�ֱ�д������ʵ��ķ�Ӧ��________�� | ѡдһ��������Ӧ�Ļ�ѧ����ʽ_______�� |
[��佻��]����С���ͬѧͨ���������ۣ����������ʾ���ջ�