题目内容
【题目】测定反应后溶液成分
查阅资料:将二氧化碳气体慢慢地通入一定量的氢氧化钠溶液中,在溶液中先后发生以下两个化学反应:
2NaOH + CO2 = Na2CO3 + H2O (先发生反应)
Na2CO3+ CO2+ H2O = 2NaHCO3 (后发生反应)
某兴趣小组开展了以下探究活动。
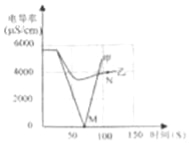
将二氧化碳气体慢慢地通入一定量的氢氧化钠溶液中,再将反应后所得溶液A按下列流程进行实验并测出相关数据:
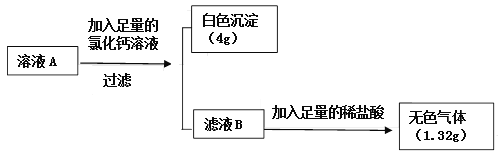
小资料: 碳酸氢盐绝大多数易溶于水, 如 Ca(HCO3)2易溶。
【获得结论】
(1)定性分析:根据上述现象,可确定溶液A中溶质成分为______________(写化学式)。
(2)定量计算:计算溶液A中各溶质的质量为_________。
【答案】 Na2CO3、 NaHCO3 溶液A中有碳酸钠4.24g,碳酸氢钠2.52g
【解析】【获得结论】反应后的溶液中加入足量氯化钙溶液,有白色沉淀生成,说明溶液中含有碳酸钠,生成的沉淀是碳酸钙,由于氯化钙足量,所以碳酸钠完全反应掉;再向滤液中加入稀盐酸,产生无色气体,说明溶液中有碳酸氢钠;碳酸钠与氯化钙反应生成碳酸钙和氯化钠,反应的化学方程式为:Na2CO3+CaCl2=2NaCl+CaCO3↓,设生成碳酸钙4g需要参加反应的碳酸钠质量为x,则:
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 100
x 4g
![]()
x=4.24g;
碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:HCl+NaHCO3=NaCl+H2O+CO2↑,设生成二氧化碳1.32g需要参加反应的碳酸氢钠质量为xg,则:HCl+NaHCO3=NaCl+H2O+CO2↑
84 44
y 1.32g
![]()
y=2.52g。

【题目】探究醋蛋液
食用醋蛋液可以补充人体所需营养,做法(如图):将洗净的鸡蛋放入盛有7°白醋的玻璃杯中,放置3天左右,用筷子将蛋清与蛋黄打散即可。

【查阅资料】食醋的主要成分为醋酸 (CH3COOH),醋酸在水中能解离出H+和CH3COO-。
【提出问题】
I.产生的气体是什么?
小英按照制作说明进行操作,把鸡蛋放入白醋中,观察到蛋壳逐渐溶解,表面有大量气泡产生,她对产生的气体进行了如下猜想:
【猜想与假设】
猜想1:二氧化碳
猜想2:氢气
猜想3:甲烷
(1)小英运用的观察方法是_______(填“直接”或“间接”)观察,小英在观察的基础上作出以上猜想的理论依据是_________________________________。
(2)假设是利用已有的知识和经验进行加工处理形成的一种能被检验的假设性结论,其表述方式为:如果……,那么……。针对以上任一种猜想做出你的假设______________。
【获得结论】实验证明,产生的气体为二氧化碳。
【反思与交流】
(3)将鸡蛋放入白醋中,蛋壳中的碳酸钙和醋酸作用生成可溶性的___________(填化学式),可以补充人体所需钙元素。除蛋白质外,醋蛋液中含钙、铁、锌、磷、钾等多种人体必需的元素,其中属于微量元素的有_______________(写元素符号)。
(4)醋蛋液中的蛋白质主要来自鸡蛋清,证明蛋清中富含蛋白质的方法是_________。
II.醋蛋液中是否含有醋酸?
【实验探究】小英同学通过测定醋蛋液的酸碱度来确定其中是否含有醋酸,请将下表填写完整。
实验操作 | 实验现象及结论 |
_______________________________________。 | 现象:_________________ 。 结论:醋蛋液中含有醋酸。 |
【反思与交流】
制得的醋蛋液中如果有过量的醋酸会灼伤、腐蚀食道黏膜及损伤脾胃,食用时可加一定量的水进行稀释,加水稀释过程中醋蛋液的pH ___________(填“增大”,“减小”或“不变”)。