题目内容
将Na2CO3和NaCl固体混合物22.3g放入烧杯中,加入182.1g稀盐酸恰好完全反应.待没有气泡溢出后,称量烧杯中剩余物质总质量为200g.请计算:
(1)生成二氧化碳的质量是_________ ;
(2)求所得溶液中溶质的质量分数是多少?
(1)4.4g (2)11.7%
解析试题分析:(1)反应生成二氧化碳的质量=22.3g+182.1g﹣200g=4.4g;故填:4.4g;
(2)设碳酸钠的质量为x,生成氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
x=10.6g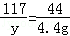
y=11.7g
所得溶液中溶质的质量分数= =11.7%
=11.7%
答:所得溶液中溶质的质量分数为11.7%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:根据质量守恒定律,反应后所得溶液的质量=固体混合物的质量+稀盐酸的质量﹣生成二氧化碳气体的质量.

练习册系列答案
相关题目
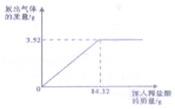
某石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将12.0g石灰石样品放入烧杯中,再取100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
| 次 数 | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入稀盐酸质量 /g | 25 | 25 | 25 | 25 |
| 反应后烧杯中物质的总质量 /g | m | 58.4 | 82.6 | 107.6 |
求:(1)生成二氧化碳的总质量是 g。
(2)第1次加入稀盐酸充分反应后,烧杯中物质的总质量是 g。
(3)该石灰石样品中碳酸钙的质量分数。(写出计算过程)