题目内容
【题目】水是重要的自然资源.
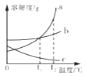
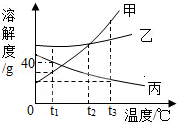
(1)水是很好的溶剂.图2为甲、乙两种固体物质在水中的溶解度曲线. ①曲线上P点的含义是 .
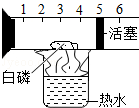
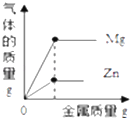
②某温度下,向分别盛有等质量甲、乙两种固体物质的试管中,加入10g水,使其充分溶解,观察到图1所示的现象.则该实验的温度(填“>”、“<”或“=”)t°c.要使甲继续溶解,又不改变溶液中溶质的质量分数,可采取的方法是 . 
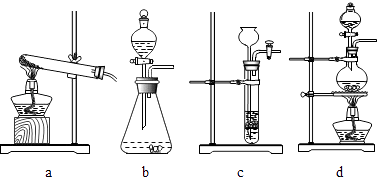
(2)自然界的水会混有各种杂质,用图3装置净化水,其中活性炭的作用是 . 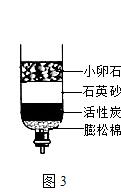
(3)为保护水资源,实验室的废液需要处理后排放,为减弱含硫酸废液的酸性,不能选用的物质是(填字母号).
A.废铁钉
B.二氧化碳
C.熟石灰
D.碳酸钠
(4)铁酸钠(Na2FeO4)是一种新型净水剂,具有絮凝和杀菌消毒等作用.请将下列制取铁酸钠的化学方程式补充完整: 2Fe (NO3)3+16NaOH+3Cl2═6NaNO3+6NaCl+2Na2FeO4+ .
【答案】
(1)t℃时,甲、乙两种固体物质的溶解度相同;<;加适量水
(2)吸附
(3)B
(4)8H2O
【解析】解:(1)①由图象可知,曲线上P点是甲、乙的溶解度曲线的交点.说明了:在t℃时,甲、乙两种固体物质的溶解度相同;②由题意可知,同温下,相同质量的水中乙溶解的多,说明了乙的溶解度比甲大,试验时的温度小于t℃时,.由于甲是饱和溶液,要使甲继续溶解,又不改变溶液中溶质的质量分数,可采取的方法是加适量的水;(2)由于活性炭有吸附性,在净化水装置中,活性炭的作用是吸附;(3)由于硫酸能与废铁钉、熟石灰、碳酸钠反应,能降低酸性,不能与二氧化碳反应,不能降低酸性.所以,为减弱含硫酸废液的酸性,不能选用的物质是二氧化碳;(4)化学反应前后原子的种类和个数不变,由此可知该反应的方程式是2Fe(NO3)3+16NaOH+3Cl2=6NaNO3+6NaCl+2Na2FeO4+8H2O. 故答为:(1)①℃时,甲、乙两种固体物质的溶解度相同;②<,加适量水(2)吸附;(3)B;(4)8H2O.
【考点精析】认真审题,首先需要了解水的净化(水的净化效果由低到高的是静置、吸附、过滤、蒸馏(均为物理方法),其中净化效果最好的操作是蒸馏;既有过滤作用又有吸附作用的净水剂是活性炭),还要掌握固体溶解度曲线及其作用(1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和))的相关知识才是答题的关键.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案