题目内容
【题目】甲、乙、丙有如图所示转化关系(“→”表示反应一步实现,部分物质和反应条件略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是.
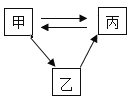
A.O2、CuO、H2O
B.Na2CO3、Na2SO4、NaOH
C.FeSO4、FeC12、Fe
D.CaCO3、CaCl2、CO2
【答案】D
【解析】
A、铜在氧气中加热生成氧化铜,氢气与氧化铜在加热条件下反应生成铜和水,氢气在氧气中燃烧生成水,水在通电的条件下反应生成氢气和氧气,按照甲、乙、丙的顺序符合要求,故选项错误;
B、碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,氢氧化钠与二氧化碳反应生成碳酸钠和水,碳酸钠与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,硫酸钠与氢氧化钡溶液反应生成硫酸钡沉淀和氢氧化钠,按照甲、乙、丙的顺序符合要求,故选项错误;
C、硫酸亚铁与氯化钡溶液反应生成硫酸钡沉淀和氯化亚铁,锌与氯化亚铁溶液反应生成氯化锌溶液和铁,锌与硫酸亚铁溶液反应生成硫酸锌溶液和铁,铁与硫酸反应生成硫酸亚铁溶液和氢气,按照甲、乙、丙的顺序符合要求,故选项错误;
D、碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,氯化钙不能通过一步反应生成二氧化碳,不能按照甲、乙、丙的顺序符合要求,故选项正确。
故选D。

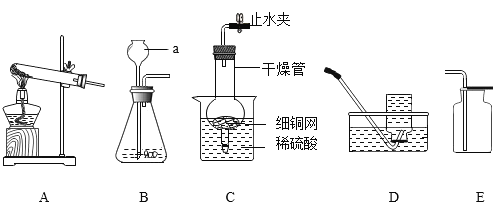
【题目】某化学兴趣小组的同学在探究金属的有关性质时,进行了如图所示实验:在A实验结束后将两支试管内的物质倒入一洁净烧杯中,一段时间后过滤 。为确定过滤后得到的滤渣和滤液的成分,同学们进行了如下实验。
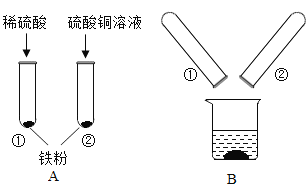
实验一:滤渣的成分是什么?
(1)甲同学取少量滤渣于试管中,加入稀硫酸,无气泡产生,证明滤渣里不含_________,乙同学通过物理方法也得到同样的结论,请简述其方法和现象:_________。
实验二:滤液里的溶质有哪些?
(2)同学们一致认为定有FeSO4,为确定可能含有其他溶质,同学们进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取少量滤液,向其中加入足量铝粉 | 产生气泡,并有红色固体析出 | 滤液里的溶质还有_______ |
请写出产生气泡反应的化学方程式:_________。
(3)有同学提出可以直接观察滤液的颜色判断滤液中是否含有硫酸铜,同学们对硫酸铜溶液为什么呈蓝色很感兴趣,决定探究硫酸铜溶液中哪种粒子使溶液呈蓝色。设计的实验方案如下:
实验操作 | 实验现象 | 实验结论 |
①取少量_______溶液,观察颜色 | 溶液呈无色 | 硫酸根离子不能使溶液呈蓝色 |
②取少量硫酸铜溶液,观察颜色 | 溶液呈蓝色 | 铜离子使溶液呈蓝色 |
(4)除了(3)中的实验方案外,你还能设计其他方案探究硫酸铜溶液中是铜离子使溶液呈蓝色吗?实验所需的药品和仪器任选,请简述实验操作和实验现象。
实验操作:___________。
实验现象:____________。
【题目】西汉东方朔所撰的《申异经》中有“西北有宫,黄铜为墙,题曰地皇之宫”的记载。黄铜是铜锌合金。为测定某黄钢样品中铜的质量分数,某同学取黄铜样品与足量稀硫酸充分反应(如图所示),测得相关数据如表。

反应前 | 反应后 | ||
装置质量 | 黄铜样品质量 | 稀硫酸质量 | 装置及装置内物质的总质量 |
260.0g | 50.0g | 100.0g | 409.5g |
计算:
(1)实验过程中,产生氢气的质量为 g。
(2)该黄铜样品中铜的质量分数(计算结果精确到0.1%)。
【题目】氯酸钾多用来制造火柴和烟花等,工业上通过如下图转化可制得氯酸钾晶体。
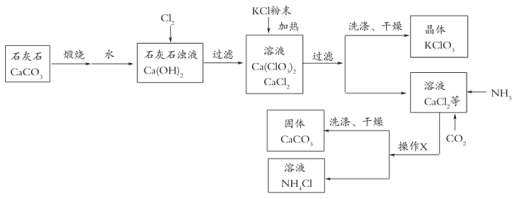
按要求回答下列问题:
(1)石灰浆浊液吸收氯气,____________元素的化合价发生改变。上述流程“操作X”的名称是___________,该操作需要用到的玻璃仪器包括烧杯、漏斗和_____________。
(2)有关物质在常温下(20 °C)的溶解度如下:
物质 | Ca( ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
上述流程中加入KCl粉末,KCl与_____________(填化学式)发生复分解反应得到KClO3晶体,该过程能得到KClO3晶体的原因是__________。
(3)写出向CaCl2溶液中通入两种气体生成CaCO3的化学方程式:_________。
(4)上述流程中能循环使用的物质是________。