题目内容
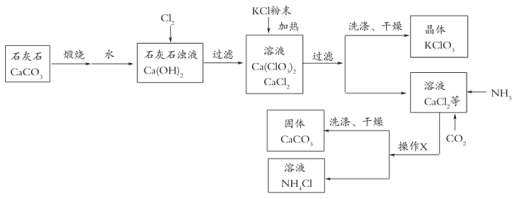
【题目】氯酸钾多用来制造火柴和烟花等,工业上通过如下图转化可制得氯酸钾晶体。
按要求回答下列问题:
(1)石灰浆浊液吸收氯气,____________元素的化合价发生改变。上述流程“操作X”的名称是___________,该操作需要用到的玻璃仪器包括烧杯、漏斗和_____________。
(2)有关物质在常温下(20 °C)的溶解度如下:
物质 | Ca( ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
上述流程中加入KCl粉末,KCl与_____________(填化学式)发生复分解反应得到KClO3晶体,该过程能得到KClO3晶体的原因是__________。
(3)写出向CaCl2溶液中通入两种气体生成CaCO3的化学方程式:_________。
(4)上述流程中能循环使用的物质是________。
【答案】氯 过滤 玻璃棒 Ca(ClO3)2 常温下(20°C)氯酸钾在水中的溶解度明显小于其他物质 ![]() CO2、CaCO3
CO2、CaCO3
【解析】
(1)石灰浆浊液吸收氯气,生成CaCl2、Ca(ClO3)2和H2O,氯气中氯元素化合价为零,CaCl2中氯元素化合价为-1价,Ca(ClO3)2中氯元素化合价为+5价,氯元素的化合价发生改变。上述流程“操作X”是将固液分离,名称是过滤,该操作需要用到的玻璃仪器包括烧杯、漏斗和玻璃棒。
(2)复分解反应是两种物质互相交换成分生成两种新的化合物的反应。上述流程及溶解度信息,加入KCl粉末,KCl与Ca(ClO3)2发生复分解反应得到KClO3晶体,该过程能得到KClO3晶体的原因是常温下(20°C)氯酸钾在水中的溶解度明显小于其他物质。
(3)根据流程向CaCl2溶液中通入的两种气体是氨气和二氧化碳,生成CaCO3同时生成NH4Cl,根据质量守恒定律,反应的化学方程式为![]() 。
。
(4)煅烧石灰石生成二氧化碳,反应后期二氧化碳作为反应物参与反应,氯化钙、氨气和二氧化碳反应生成碳酸钙,上述流程中能循环使用的物质是CO2、CaCO3。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案