��Ŀ����
����Ŀ��������������άϵ��Ҫˮ����ѧ�о��벻��ˮ�������������̽����
̽��һ����ˮ���ܼ�����ʢ��5mlˮ��5ml���͵���ֻ�Թ��и�����1��2С��������أ��ɹ۲쵽��������_____�����ۣ�ͬһ�������ڲ�ͬ�ܼ��е��ܽ��Բ�ͬ��
̽��������ˮ�������ʣ���ѡ���ְ�ɫ���壬��ˮ�������ǣ����ʵ������±����ݣ�
���ְ�ɫ���� | ��Ҫ����������ͽ��� |
_____ | _____ |
̽������������ˮ�е��ܽ���ᾧ��
���������ϡ�20��ʱ���������ʵ��ܽ�����±���
���� | NaCl�� | ��NH4HCO3 | NH4Cl�� | NaHCO3 | Na2CO3 |
���ܽ��/g | ��36.0 | 21.0 | ��37.2 | 9.6 | 21.5 |
��ͬ�¶��£���ͬ����ͬʱ�ܽ���ͬһ�ܼ��У��ܽ�Ȳ��䣮
��������⡿20��ʱ����11.7gNaCl��15.8gNH4HCO3ͬʱ����ʢ��100gˮ���ձ��У���ֽ��裬���ã��о�������(�¶���Ϊ20��)�������ľ�����ʲô��
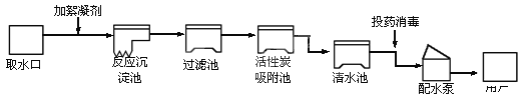
�����ʵ�顿��Ʒ�����������ʵ�飮
(1)ȡ������������ʯ�ҷ�ĩ��ϡ���ĥ������������ʵ��Ŀ����_____��
(2)ȡ�����������Թ��У�����_____������Ϊ_____��
��ʵ����ۡ�(3)�����ľ�����_____�����������Ϊ_____g��
��ʵ����չ��(4)���������ԭ����_____��
���𰸡� �����������ˮ�γ��Ϻ�ɫ��Һ��������������������� ̼��ơ������� �ֱ����ֹ����ˮ�ܽ⣬������ˮ����̼��ƣ���ˮ���ҷ�Ӧ���������ų����������� ֤�����岻���Ȼ�� ���� ����ɫ������� NaHCO3 7.2 NaCl��NH4HCO3����ˮδ�ﱥ�ͣ����Բ����Ծ���������������ˮ�н����Na+��Cl����NH4+��HCO3�������������˶���ϳ�NaHCO3 ��NH4Cl������NH4Cl�ܽ�Ƚϴ�δ�ﱥ�ͣ��ʲ�����������NaHCO3���ܽ��С������Һ�Ѵﱥ�ͣ����Թ����NaHCO3�Ծ�����ʽ����
��������̽��һ�������������ˮ�γ��Ϻ�ɫ��Һ���������������������
̽������ѡ��̼��ơ������ƣ���Ҫ����������ͽ��۷ֱ����ֹ����ˮ�ܽ⣬������ˮ����̼��ƣ���ˮ���ҷ�Ӧ���������ų����������ƣ����𰸺������ɣ�
̽������(1) 20��ʱ�Ȼ��Ƶ��ܽ�ȴ���11.7g��̼����淋��ܽ�ȴ���15.8g�����߶���������������Һ�е�Na+��Cl����NH4+��HCO3�����������������ܳ����Ȼ�狀�̼�����ƣ�笠������������������ӻ�ų��������ʸò�����֤�����岻���Ȼ�泥���2��NaHCO3���ܽ��С�����Ѿ�֤�������Ȼ�泥���Ӧ����̼����泥���֤̼�������ϡ���ᣬ������������ð������3��15.8gNH4HCO3��̼�����������Ϊ
15.8g![]() =12.2g����12.2g��̼�������̼�����Ƶ�����Ϊ��12.2g
=12.2g����12.2g��̼�������̼�����Ƶ�����Ϊ��12.2g![]() =16.8g��20��ʱ̼�����Ƶ��ܽ��Ϊ9.6g����������̼�����ƾ��������Ϊ16.8g-9.6g=7.2g����4�����������ԭ��ͬ(1)����2����
=16.8g��20��ʱ̼�����Ƶ��ܽ��Ϊ9.6g����������̼�����ƾ��������Ϊ16.8g-9.6g=7.2g����4�����������ԭ��ͬ(1)����2����