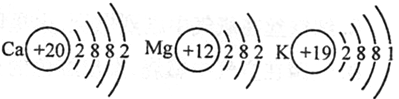题目内容
(2011年湖北武汉,7题)某工厂排放的废液中含有少量硫酸和硫酸铜。小军同
学取适量废液放入盛有一定量锌粉的烧杯中,搅拌,待充分反应后过滤,得少量滤渣和滤液。
关于该实验,下列说法正确的是
学取适量废液放入盛有一定量锌粉的烧杯中,搅拌,待充分反应后过滤,得少量滤渣和滤液。
关于该实验,下列说法正确的是
| A.反应前后液体的酸性减弱,pH变小 |
| B.实验所得滤液是纯水,可直接排放 |
| C.滤渣中一定含铜和锌 |
| D.发生的反应都是置换反应 |
D
本题考查的是酸的化学性质,金属的化学性质,溶液的酸碱性与pH值的关系,反应类型的判定。在金属活动性顺序中,锌排在铜和氢的前边,可以和稀硫酸、硫酸铜溶液反应。
A、反应后液体的酸性减弱,pH应该变大,不是变小,故此项错误;
B、实验所得滤液中至少含有硫酸锌,因此不是纯水,不可直接排放,此项错误;
C、如果锌的量比较少,没有能消耗完酸与硫酸铜,滤渣中就不可能有锌,此项错误;
D、因为金属和盐、金属和酸发生的反应都是置换反应,所以锌与硫酸及硫酸铜的反应均属置换反应,故此项正确。故选D
A、反应后液体的酸性减弱,pH应该变大,不是变小,故此项错误;
B、实验所得滤液中至少含有硫酸锌,因此不是纯水,不可直接排放,此项错误;
C、如果锌的量比较少,没有能消耗完酸与硫酸铜,滤渣中就不可能有锌,此项错误;
D、因为金属和盐、金属和酸发生的反应都是置换反应,所以锌与硫酸及硫酸铜的反应均属置换反应,故此项正确。故选D

练习册系列答案
相关题目
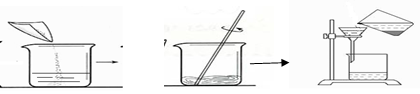
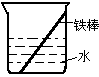
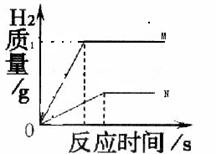
 ____ 。
____ 。