��Ŀ����
��8�֣��ڽ������˳����������λ��Խ��ǰ�����Ļ�Ծ�Խǿ���ڻ�ѧ��Ӧ��Խ����ʧȥ���ӡ�
(1)Ca��Mg��K���ֽ����ڻ�ѧ��Ӧ��ʧȥ���ӵ�������ǿ������˳����__ _��
(2) Ca��Mg��K���ֽ�����ԭ�ӽṹʾ��ͼ����ͼ��ʾ��
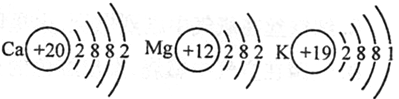
����������ֽ�����ԭ�ӽṹʾ��ͼ�������ѧ�����й�ԭ�ӽṹ��֪ʶ�Ʋ⣺��������ʧȥ����������ǿ����Ҫ����Щ�����йأ� ���δ����㣩��
(3)��֤��Cu�Ľ�����Ա�Agǿ�ķ����ǣ� ���û�ѧ����ʽ��ʾ����
(4)�ǽ�������Ҳ�������ƽ���������Һ֮����û���Ӧ���ɣ�����Խ�ǿ�ķǽ����ɰѻ�Խ����ķǽ�����������Һ���û����������磬����Һ�пɷ������·�Ӧ�� Cl2 +2NaBr ="2NaCl+" Br2; Br2 +2KI ="2KBr" +I2��;
I2 +Na2S =2NaI+S �ɴ˿����ж���(S)����( Br2)����(I2)������(Cl2)���ַǽ������ʵĻ��������ǿ��˳����� ��
(1)Ca��Mg��K���ֽ����ڻ�ѧ��Ӧ��ʧȥ���ӵ�������ǿ������˳����__ _��
(2) Ca��Mg��K���ֽ�����ԭ�ӽṹʾ��ͼ����ͼ��ʾ��
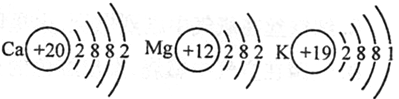
����������ֽ�����ԭ�ӽṹʾ��ͼ�������ѧ�����й�ԭ�ӽṹ��֪ʶ�Ʋ⣺��������ʧȥ����������ǿ����Ҫ����Щ�����йأ� ���δ����㣩��
(3)��֤��Cu�Ľ�����Ա�Agǿ�ķ����ǣ� ���û�ѧ����ʽ��ʾ����
(4)�ǽ�������Ҳ�������ƽ���������Һ֮����û���Ӧ���ɣ�����Խ�ǿ�ķǽ����ɰѻ�Խ����ķǽ�����������Һ���û����������磬����Һ�пɷ������·�Ӧ�� Cl2 +2NaBr ="2NaCl+" Br2; Br2 +2KI ="2KBr" +I2��;
I2 +Na2S =2NaI+S �ɴ˿����ж���(S)����( Br2)����(I2)������(Cl2)���ַǽ������ʵĻ��������ǿ��˳����� ��
��8�֣�(l)K>Ca>Mg (2)���������� ���Ӳ���
(3) Cu +2AgN03 =Cu(N03)2 +2Ag (4)S<12<Br2<C12������<��<��<������
(3) Cu +2AgN03 =Cu(N03)2 +2Ag (4)S<12<Br2<C12������<��<��<������
����1��Ca��Mg��K���ֽ������ǿ��˳��ΪK��Ca��Mg���ʸ�����Ŀ������Ϣ��֪���ڻ�ѧ��Ӧ��ʧȥ���ӵ�������ǿ������˳����K��Ca��Mg��
��2������Ԫ�ػ�ѧ���ʵ���������������ԭ�ӵĵ��Ӳ���Խ�࣬������������һ���������£���Խ����ʧȥ���ӣ��ʽ�������ʧȥ����������ǿ����Ҫ�����������������Ӳ����йأ�
��3������ͭ�Ļ�ѧ���ʱ������ã���˿���ѡ��ͭ����������Һ��Ӧ��֤��ͭ�������ã�
��4���ǽ�������Ҳ�������Ƶ��û���Ӧ���ɣ�����Խ�ǿ�ķǽ����ɰѻ�Խ����ķǽ�����������Һ���û��������ɷ�ӦC12+2NaBr=2NaCl+Br2�ɵ÷ǽ�����C12��Br2��ͬ���ɵ�I2��S��Br2��I2����ѡC12��Br2��I2��S�������ַǽ������ʵĻ��������ǿ��˳���S��12��Br2��C12��
�ʴ�Ϊ����l��K��Ca��Mg��
��2�����������������Ӳ�����
��3��Cu+2AgN03=Cu��N03��2+2Ag��
��4��S��12��Br2��C12�����⣼�壼��������
��2������Ԫ�ػ�ѧ���ʵ���������������ԭ�ӵĵ��Ӳ���Խ�࣬������������һ���������£���Խ����ʧȥ���ӣ��ʽ�������ʧȥ����������ǿ����Ҫ�����������������Ӳ����йأ�
��3������ͭ�Ļ�ѧ���ʱ������ã���˿���ѡ��ͭ����������Һ��Ӧ��֤��ͭ�������ã�
��4���ǽ�������Ҳ�������Ƶ��û���Ӧ���ɣ�����Խ�ǿ�ķǽ����ɰѻ�Խ����ķǽ�����������Һ���û��������ɷ�ӦC12+2NaBr=2NaCl+Br2�ɵ÷ǽ�����C12��Br2��ͬ���ɵ�I2��S��Br2��I2����ѡC12��Br2��I2��S�������ַǽ������ʵĻ��������ǿ��˳���S��12��Br2��C12��
�ʴ�Ϊ����l��K��Ca��Mg��
��2�����������������Ӳ�����
��3��Cu+2AgN03=Cu��N03��2+2Ag��
��4��S��12��Br2��C12�����⣼�壼��������

��ϰ��ϵ�д�
 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
�����Ŀ