题目内容
【题目】纯碱是化学工业生产中一种非常重要的化工原料. 反应原理:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl,2NaHCO3═Na2CO3++H2O+CO2↑
已知:常温下氨气极易溶于水,1体积水大约可以溶解700体积的氨气;二氧化碳可溶于水,1体积水大约可以溶解1体积二氧化碳.
某课外活动小组模拟工业流程来制备纯碱,实验装置、所需实验药品和装置如图所示: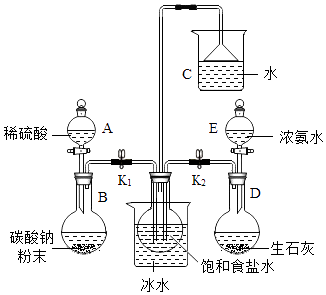
实验步骤:
(1)连接好装置并 .
(2)中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中; D中加入足量生石灰固体,E中加入足量浓氨水,利用该方法制取氨气的原理是(写一点即可),根据该原理,生石灰也可以用固体代替;B中加入足量碳酸钙粉末,A中加入足量稀硫酸(可分多次加入),写出该反应的化学方程式 , 选择用稀硫酸而不用稀盐酸的理由是
(3)制备NaHCO3:先打开弹簧夹(填K1或K2),使对应一侧烧瓶中生成的气体进入饱和食盐水,大约20分钟左右时,再打开另一个弹簧夹,使其一侧的烧瓶中生成的气体进入饱和食盐水,大约5分钟即有浑浊出现,约15分钟出现大量白色固体.这种气体通入先后顺序的目的是 . 在该实验过程中,中间的烧瓶浸入冰水中的目的: .
(4)制备纯碱:欲得到纯碱,上述实验结束后,将固体过滤、洗涤后,还需进行的操作是;若将制得的纯碱放入足量的稀硫酸中,并将生成的气体全部通入氢氧化钠溶液中,溶液质量增加0.88g,则步骤(3)中制得的NaHCO3的质量是多少?(写出计算过程)
【答案】
(1)检查装置气密性
(2)氧化钙溶于水放热,降低氨气的溶解度;氢氧化钠;CaCO3+H2SO4═CaSO4+H2O+CO2↑;盐酸易挥发
(3)K2;先通入氨气使溶液显碱性,有利于吸收二氧化碳;吸收更多的气体,降低碳酸氢钠的溶解度
(4)加热;设步骤(3)中制得的NaHCO3的质量为x, 由2NaHCO3 ![]() Na2CO3+H2O+CO2↑,Na2CO3+H2SO4═Na2SO4+H2O+CO2↑可知,2NaHCO3~CO2↑,
Na2CO3+H2O+CO2↑,Na2CO3+H2SO4═Na2SO4+H2O+CO2↑可知,2NaHCO3~CO2↑,
2NaHCO3~ | CO2↑ |
168 | 44 |
x | 0.88g |
![]() =
= ![]() ,
,
x=3.36g,
答:步骤(3)中制得的NaHCO3的质量是3.36g
【解析】解:(1)搭好装置并检查装置气密性,以防装置漏气影响实验结果. 故填:检查装置气密性.(2)利用该方法制取氨气的原理是氧化钙溶于水放热,降低氨气的溶解度;
根据该原理,生石灰也可以用氢氧化钠固体代替;
B中加入足量碳酸钙粉末,A中加入足量稀硫酸,稀硫酸和碳酸钙反应生成硫酸钙、水和二氧化碳,该反应的化学方程式为:CaCO3+H2SO4═CaSO4+H2O+CO2↑
, 选择用稀硫酸而不用稀盐酸的理由是盐酸易挥发,会导致二氧化碳中混有氯化氢气体.
故填:氧化钙溶于水放热,降低氨气的溶解度;氢氧化钠;CaCO3+H2SO4═CaSO4+H2O+CO2↑;盐酸易挥发.(3)制备NaHCO3时,先打开弹簧夹 K2 , 使对应一侧烧瓶中生成的气体进入饱和食盐水,大约20分钟左右时,再打开另一个弹簧夹,使其一侧的烧瓶中生成的气体进入饱和食盐水,大约5分钟即有浑浊出现,约15分钟出现大量白色固体.这种气体通入先后顺序的目的是先通入氨气使溶液显碱性,有利于吸收二氧化碳;
在该实验过程中,中间的烧瓶浸入冰水中的目的是:吸收更多的气体,降低碳酸氢钠的溶解度.
故填:K2;先通入氨气使溶液显碱性,有利于吸收二氧化碳;吸收更多的气体,降低碳酸氢钠的溶解度.
【考点精析】利用书写化学方程式、文字表达式、电离方程式和根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知注意:a、配平 b、条件 c、箭号;各物质间质量比=系数×相对分子质量之比.
