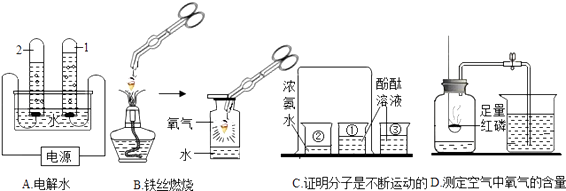
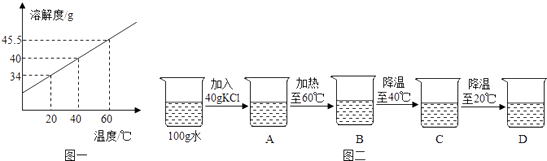
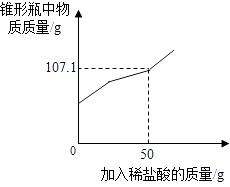
��Ŀ����
����Ŀ��ͬѧ�Ƿ���NaOH��Һ��NaHCO3��Һ��Ϻ����������������ʣ����������Ƿ����˻�ѧ��Ӧ������ʦ�İ����£�����ͨ������̽������֤��NaHCO3��Һ��NaOH��Һ�����˷�Ӧ�� 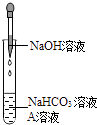
��1��ʵ��װ��
�ٲ������ϣ�NaHCO3+NaOH�TNa2CO3+H2O
����һ�����ʵ�����������NaHCO3��NaOH��Na2CO3������Һ��������ʵ�飬Ϊ���ʵ�鷽���ṩ�ο���
NaHCO3��Һ | NaOH��Һ | Na2CO3��Һ | |
����ϡ���� | ����� | �����Ա仯 | �������� |
�������ʯ��ˮ | ��Һ����� | �����Ա仯 | ����� |
����CaCl2��Һ | �����Ա仯 | ��Һ����� | ��Һ����� |
������Һ�����ڣ��� | ����ʯ��ˮ | ����ʯ��ˮ | ����ʯ��ˮ |
���е������Ϊ �� ������Ӧ��Ӧ�Ļ�ѧ����ʽΪ ��
��2��ʵ�����
��ʵ��1��֤����Ӧ������Na2CO3
ͬѧ��ѡ���ϱ�ʵ���е�ҩƷ���������ͼ��ʾʵ�飬����NaHCO3��Һ�м���A��Һ�������������ٵμ�NaOH��Һ����Һ����ǣ���A��Һ�� ��
��ͬѧ������ʵ�鲻����֤����Na2CO3���ɣ��������� �� Ϊ��֤����Na2CO3���ɣ���Ҫ�������еIJ����� ��
��ʵ��2��֤����Ӧ��NaHCO3������
ͬѧ�Dzο��ϱ��е�ʵ�飬�������һ��ʵ�飬��Ȼû�й۲쵽���Ե�ʵ����������֤����Ӧ�����ˣ���ʵ�鷽���� ��
��3��ʵ�鷴˼
ͨ��ʵ��1��ʵ��2˵��������û����������Ļ�ѧ��Ӧ�����Դ�������ͬ�ĽǶ�֤����Ӧ�ķ������������Ƕ��� ��
���𰸡�
��1�������ݲ�����Ca��OH��2+Na2CO3=2NaOH+CaCO3��
��2��CaCl2��CaCl2 ��NaOH��Ӧ����Ca��OH��2 �� �����������������Һ��Ҳ����������ȡ������Ӧ����Һ����������ϡ���ᣬ��������ɫ����֤����Na2CO3���ɣ���֮��û�У�ȡ������Ӧ�����Һ���������ڣ�������ͨ�����ʯ��ˮ��������ʯ��ˮ����ǣ�֤���У�NaHCO3���ڣ���֮��û��
��3��һ�ǿ���ͨ�����鷴Ӧ��֤����Ӧ���������ǿ���ͨ���������֤����Ӧ����
���������⣺��1����ϡ�����̼�����Ʒ�Ӧ���ɶ�����̼���壬���Է�Ӧ����Ϊ�������ݲ������������ƺ�̼���Ʒ�Ӧ�����������ƺ�̼��ƣ���Ӧ�ķ���ʽΪ��Ca��OH��2+Na2CO3=2NaOH+CaCO3�������Դ��ǣ������ݲ�����Ca��OH��2+Na2CO3=2NaOH+CaCO3������2����ʵ��1���ɱ�֪��̼�����ƺ��Ȼ��Ʒ�Ӧ�������������������ƣ�̼���������������Ʒ�Ӧ����̼���ƣ�̼�������Ȼ��Ʒ�Ӧ���ɳ��������ɱ�֪���Ȼ������������Ʒ�Ӧ�����������ƣ������������������Һ��Ҳ����������Ϊ֤����Һ�������ɵ�̼���ƣ����Լ���������ϡ���ᣬ�������ݲ��������У������ޣ����Դ��ǣ�CaCl2��CaCl2 ��NaOH��Ӧ����Ca��OH��2 �� �����������������Һ��Ҳ����������ȡ������Ӧ����Һ����������ϡ���ᣬ��������ɫ����֤����Na2CO3���ɣ���֮��û�У�
��ʵ��2����Ϊ̼���������ȷֽ�����̼���ơ�ˮ�Ͷ�����̼�����ѷ�Ӧ�����Һ���ȣ��ó����ʯ��ˮ������û�ж�����̼���ɣ����Դ��ǣ�ȡ������Ӧ�����Һ���������ڣ�������ͨ�����ʯ��ˮ��������ʯ��ˮ����ǣ�֤���У�NaHCO3���ڣ���֮��û�У�3��ͨ��ʵ��1��ʵ��2˵��������û����������Ļ�ѧ��Ӧ��ͨ�����鷴Ӧ��֤����Ӧ����������ͨ���������֤����Ӧ���������Դ��ǣ�һ�ǿ���ͨ�����鷴Ӧ��֤����Ӧ���������ǿ���ͨ���������֤����Ӧ������
�𰸣���1�������ݲ�����Ca��OH��2+Na2CO3=2NaOH+CaCO3������2����ʵ��1��CaCl2��CaCl2 ��NaOH��Ӧ����Ca��OH��2 �� �����������������Һ��Ҳ����������ȡ������Ӧ����Һ����������ϡ���ᣬ��������ɫ����֤����Na2CO3���ɣ���֮��û�У���ʵ��2��ȡ������Ӧ�����Һ���������ڣ�������ͨ�����ʯ��ˮ��������ʯ��ˮ����ǣ�֤���У�NaHCO3���ڣ���֮��û�У���3��һ�ǿ���ͨ�����鷴Ӧ��֤����Ӧ���������ǿ���ͨ���������֤����Ӧ������
�����㾫�����������⣬������Ҫ�˽���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ(ע�⣺a����ƽ b������ c������)��