题目内容
【题目】某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠和一瓶未标浓度的稀盐酸,为测定氢氧化钠的变质情况和稀盐酸的浓度,他们取9.3g变质的氢氧化钠样品于锥形瓶中,加入50g水,充分溶解,再向锥形瓶中滴加未知浓度的稀盐酸,实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图所示.
求: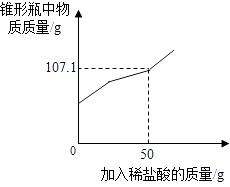
(1)9.3g样品中碳酸钠的质量.
(2)未知浓度的稀盐酸的溶质质量分数.
【答案】
(1)
解:由图中的质量关系图可知:产生二氧化碳的质量:(9.3g+50g+50g)﹣107.1g=2.2g
设9.3g样品中碳酸钠的质量为x,与碳酸钠反应的氯化氢的质量为y,与氢氧化钠反应的氯化氢的质量为z,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x y 2.2g
![]() ,
, ![]()
x=5.3g,y=3.65g
NaOH + HCl═NaCl+H2O
40 36.5
(9.3g﹣5.3g) z
![]()
z=3.65g
答: 9.3g样品中碳酸钠的质量是5.3g
(2)
解:稀盐酸的溶质质量分数: ![]() =14.6%
=14.6%
答:稀盐酸的溶质质量分数是14.6%
【解析】根据氢氧化钠会吸收空气中二氧化碳而生成碳酸钠,碳酸钠与盐酸反应生成二氧化碳气体会造成物质的总质量减少,根据质量守恒定律计算出二氧化碳的质量,进而可以根据化学方程式计算出碳酸钠的质量、参加反应的氯化氢的质量,即可求出盐酸溶液中溶质的质量分数.
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

【题目】同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应. 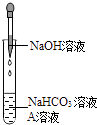
(1)实验装备
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
②用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考.
NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
加入稀盐酸 | 现象Ⅰ | 无明显变化 | 产生气泡 |
加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 现象Ⅱ |
加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
加热溶液至沸腾,将 | 澄清石灰水 | 澄清石灰水 | 澄清石灰水 |
表中的现象Ⅰ为 , 现象Ⅱ对应反应的化学方程式为 .
(2)实验过程
【实验1】证明反应生成了Na2CO3
同学们选用上表实验中的药品,设计了如图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是 .
有同学提出这个实验不足以证明有Na2CO3生成,其理由是 . 为了证明有Na2CO3生成,需要继续进行的操作是 .
【实验2】证明反应后NaHCO3不存在
同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是 .
(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是 .