题目内容
【题目】汽车是现代生活中不可缺少的代步工具。请回答下列问题
(1)汽车电路中的导线大都是铜制的,这是种用了金属铜的延展性和__________性。
(2)下列汽车配件及用品中,属于有机合成材料的是填序号下同__________。
a.钢铁外壳 b.玻璃车窗 c.橡胶轮胎 d.羊毛座垫
(3)铁在潮湿的空气中容易锈蚀。
①汽车表面喷漆,可以延缓气车的锈蚀,其防锈原理是隔绝__________和水。
②喷漆前需将铁制品短时间放入稀盐酸中除锈,铁锈主要成分是Fe2O3,观察到__________,除锈的化学方程式是__________。
③回收利用生锈的铁制品是保护金属资源的有效途径。在工业上常用一氧化碳将其还原回收,反应的化学方程式是__________。
④为测定某生锈的铁制品中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g样品充分反应(杂质不能与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.
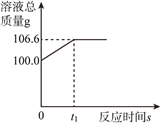
a.上述反应产生二氧化碳的质量为__________g;
b.计算该赤铁矿石中氧化铁的质量分数__________。
【答案】 导电 c O2 铁锈逐渐消失,溶液由无色变为黄色 Fe2O3+6HCl![]() 2FeCl3+3H2O 3CO+Fe2O3
2FeCl3+3H2O 3CO+Fe2O3![]() 2Fe+3CO2 6.6 80%
2Fe+3CO2 6.6 80%
【解析】(1)汽车电路中的导线多数是用铜制做的,这是利用了金属铜的导电性和延展性;
(2)钢铁属于铁碳合金,玻璃属于无机非金属材料,橡胶轮胎属于有机高分子材料,羊毛座垫属于天热纤维,故选c;
(3)①汽车表面喷漆,可以延缓汽车的锈蚀,其防锈原理是隔绝空气(氧气)和水;
②锈的主要成分是氧化铁,氧化铁能和稀盐酸反应生成氯化铁和水,氯化铁溶液是黄色的,反应初期可观察到铁锈逐渐消失,溶液由无色变为黄色,化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;
③一氧化碳具有还原性,能在高温下将氧化铁还原为铁,同时生成二氧化碳,化学方程式为:Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
④二氧化碳能与氢氧化钠反应生成碳酸钠和水,故溶液的增重值即为二氧化碳的质量,由图象知,反应产生二氧化碳的质量为106.6g-100.0g=6.6g;
设赤铁矿石中氧化铁的质量为x,
Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
160 3×44
x 6.6g
![]()
解得x=8.0g
样品中氧化铁的质量分数为![]() =80%
=80%
答:样品中氧化铁的质量分数为80%。

【题目】某钙片的标签如图,且知此钙片成分中只有碳酸钙含有钙元素。
主要成分:碳酸钙(CaCO3)维生素D |
规 格:每瓶50片,净重40克 |
含 钙 量:每片含钙0.75克 |
(1)其中维生素D2有助于钙的吸收,它的化学式为C28H44O,它的相对分子质量为_______;
(2)根据标签中的含钙量计算出,每片该片中碳酸钙的含量为_________g;
(3)标签中的含钙量是否合理__________(填“是”或“否”)?





