题目内容
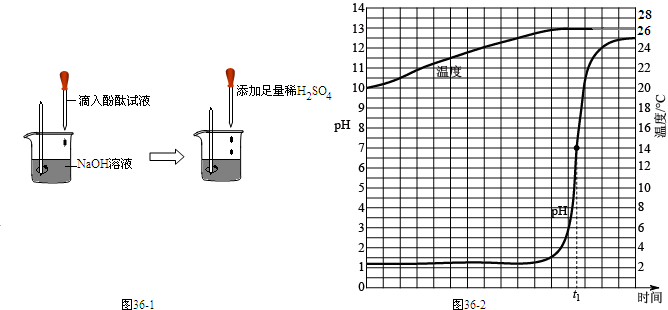
在研究酸和碱的化学性质时,某小组想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案设计、实施和评价.
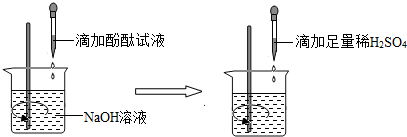
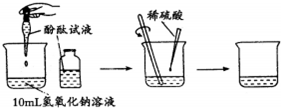
[实验探究](1)探究稀H2SO4与NaOH溶液的反应
①当滴入几滴酚酞溶液后,溶液由无色变为
②根据上述实验中颜色变化,确定稀H2SO4与NaOH溶液发生了化学反应,化学方程式为
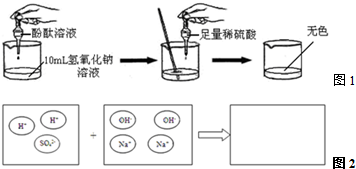
③为理解稀H2SO4与NaOH溶液两者之间发生反应的微观实质,绘制了图2,请分析并在右边框内填上生成物的微粒符号.
(2)探究上述稀H2SO4与NaOH溶液反应后烧杯中硫酸是否过量,根据上述反应过程中溶液变成无色,不能确定稀H2SO4是否过量,同学们又分别选取BaCl2、紫色石蕊溶液设计实验方案,请你判断并分析:
[实验评价]上述设计的实验方案中,正确的是方案
[实验反思]探究硫酸和氢氧化钠反应后稀H2SO4是否有剩余,还可选择一种试剂
[实验探究](1)探究稀H2SO4与NaOH溶液的反应

①当滴入几滴酚酞溶液后,溶液由无色变为
红
红
色.②根据上述实验中颜色变化,确定稀H2SO4与NaOH溶液发生了化学反应,化学方程式为
2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
.③为理解稀H2SO4与NaOH溶液两者之间发生反应的微观实质,绘制了图2,请分析并在右边框内填上生成物的微粒符号.
(2)探究上述稀H2SO4与NaOH溶液反应后烧杯中硫酸是否过量,根据上述反应过程中溶液变成无色,不能确定稀H2SO4是否过量,同学们又分别选取BaCl2、紫色石蕊溶液设计实验方案,请你判断并分析:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的BaCl2溶液 | 出现白色沉淀 | 稀H2SO4过量 |
| 方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 稀H2SO4过量 |
二
二
(填“一”或“二”).另外一个实验方案错误的原因是方案一错误的原因是溶液中有生成的硫酸钠,加入氯化钡溶液同样产生白色沉淀
方案一错误的原因是溶液中有生成的硫酸钠,加入氯化钡溶液同样产生白色沉淀
.[实验反思]探究硫酸和氢氧化钠反应后稀H2SO4是否有剩余,还可选择一种试剂
碳酸钠溶液
碳酸钠溶液
.分析:(1)①根据酚酞遇碱变红色分析,②根据反应物、生成物写出化学方程式;③根据硫酸与氢氧化钠反应的生成物是硫酸钠和水,实质参加反应的是氢离子和氢氧根离子结合成水;
(2)根据生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀和石蕊试液遇酸变红色以及碳酸钠溶液与酸反应生成二氧化碳填写.
(2)根据生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀和石蕊试液遇酸变红色以及碳酸钠溶液与酸反应生成二氧化碳填写.
解答:解:(1)①酚酞遇碱变红色,所以氢氧化钠溶液使酚酞试液变红;
②氢氧化钠与稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O;
③硫酸与氢氧化钠反应的生成物是硫酸钠和水,实质参加反应的是氢离子和氢氧根离子结合成水,微观粒子是水分子和钠离子、硫酸根离子;
(2)因为方案一即使硫酸不过量,生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀,而石蕊试液遇酸变红色,所以方案二正确,因为碳酸钠溶液与酸反应生成二氧化碳,所以可以加入碳酸钠溶液来鉴别,故答案为:方案二;方案一错误的原因是溶液中有生成的硫酸钠,加入氯化钡溶液同样产生白色沉淀;碳酸钠溶液.
故答案为:(1)①红;②2NaOH+H2SO4=Na2SO4+2H2O;③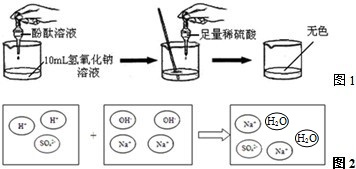
(2)二;方案一错误的原因是溶液中有生成的硫酸钠,加入氯化钡溶液同样产生白色沉淀;碳酸钠溶液.
②氢氧化钠与稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O;
③硫酸与氢氧化钠反应的生成物是硫酸钠和水,实质参加反应的是氢离子和氢氧根离子结合成水,微观粒子是水分子和钠离子、硫酸根离子;
(2)因为方案一即使硫酸不过量,生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀,而石蕊试液遇酸变红色,所以方案二正确,因为碳酸钠溶液与酸反应生成二氧化碳,所以可以加入碳酸钠溶液来鉴别,故答案为:方案二;方案一错误的原因是溶液中有生成的硫酸钠,加入氯化钡溶液同样产生白色沉淀;碳酸钠溶液.
故答案为:(1)①红;②2NaOH+H2SO4=Na2SO4+2H2O;③

(2)二;方案一错误的原因是溶液中有生成的硫酸钠,加入氯化钡溶液同样产生白色沉淀;碳酸钠溶液.
点评:本题考查了酸碱中和反应,要完成此题可以依据已有的知识进行,所以要求同学们在平时的学习中加强基础知识的储备.

练习册系列答案
相关题目