题目内容
在2011年某市初中化学实验考查中,同学们对下面两组实验进行了探究.一,在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案的设计、实施和评价.
(1)方案一:观察
结论:稀H2SO4与NaOH溶液发生了化学反应.反应的方程式为
(2)方案二:测量酸和碱反应过程的pH、温度变化取一定量的稀硫酸,逐滴匀速滴加NaOH溶液,用传感器实时获得溶液的pH、温度曲线如图36-2
①0-t1时,溶液的酸碱性变化情况是
②由图2中pH变化情况分析,酸和碱发生反应的依据是
“放热”).
结论:稀H2SO4与NaOH溶液发生了化学反应.
二,探究澄清石灰水的相关性质.
已知:a.二氧化碳通入碳酸钙的悬浊液中发生如下反应:CaCO3+H2O+CO2═Ca(HCO3)2;
b.碳酸氢钙微溶于水,微热易分解:Ca(HCO3)2
| ||
(1)取一滴管饱和的石灰水于试管中,在酒精灯上加热,出现浑浊,原因是
(2)取一滴管饱和的石灰水于试管中,用嘴通过吸管向石灰水中不停地吹气,可观察到的现象是
(3)配制1:3(1体积的饱和石灰水加3体积的水)和1:7的石灰水,分别用吸管吹气.观察到l:3的石灰水出现浑浊,1:7的不出现浑浊.出现浑浊试管内发生反应的化学方程式为
A.CO2与1:7的石灰水不发生反应,所以没出现浑浊
B.CO2与1:7的石灰水反应,生成极少量的碳酸钙在水中完全溶解,所以没有出现浑浊.
分析:一、(1)根据碱遇酚酞变红,利用酸碱反应使碱减少,颜色变化来分析;
(2)根据图中的PH变化和温度变化来分析溶液酸碱性的变化及热效应;
二、(1)利用温度对饱和溶液的溶解度的影响来解答;
(2)根据二氧化碳与石灰水的反应及Ca(HCO3)2
CaCO3↓+H2O+CO2来分析现象;
(3)根据二氧化碳与石灰水的反应及生成碳酸钙的质量的多少来分析.
(2)根据图中的PH变化和温度变化来分析溶液酸碱性的变化及热效应;
二、(1)利用温度对饱和溶液的溶解度的影响来解答;
(2)根据二氧化碳与石灰水的反应及Ca(HCO3)2
| ||
(3)根据二氧化碳与石灰水的反应及生成碳酸钙的质量的多少来分析.
解答:解:一、(1)因酚酞滴入到氢氧化钠溶液中变为红色,当向碱性溶液中加稀硫酸时,发生H2SO4+2NaOH═Na2SO4+2H2O反应使碱减少至消失,则红色逐渐变浅至消失,即可利用溶液颜色的变化来判断发生反应,故答案为:将稀硫酸加入到滴有酚酞试液的氢氧化钠溶液中是否有颜色变化;H2SO4+2NaOH═Na2SO4+2H2O;
(2)①由图可知PH在不断变大,t1时PH为7,即溶液的酸性减弱,t1时变为中性,故答案为:溶液酸性减弱,t1时变为中性;
②判断发生酸和碱发生反应的依据是根据图中PH变化,利用温度在升高可判断反应是放热反应,故答案为:溶液PH增大,t1时PH=7;放热;
二、(1)因溶液为饱和溶液,且氢氧化钙的溶解度随温度的升高而减小,则在酒精灯上加热,有氢氧化钙析出而使溶液变浑浊,当放入盛冷水的烧杯中冷却降低温度时,溶解度变大,固体又溶解,则溶液变澄清,故答案为:氢氧化钙的溶解度随温度升高而减小;浑浊的石灰水变澄清;
(2)因二氧化碳能与澄清石灰水反应生成碳酸钙沉淀和水,则使溶液变浑浊,继续吹二氧化碳,则发生碳酸钙和水和二氧化碳生成能溶于水的碳酸氢钙,即反应为CaCO3+H2O+CO2═Ca(HCO3)2,则现象为先浑浊后变澄清,当对此溶液加热时发生Ca(HCO3)2
CaCO3↓+H2O+CO2反应,有碳酸钙沉淀生成,则现象为变浑浊,故答案为:先浑浊后变澄清;变浑浊;
(3)因l:3的石灰水出现浑浊,则是发生Ca(OH)2+CO2═CaCO3↓+H2O反应,而1:7的石灰水不出现浑浊不出现浑浊,也发生了同样的反应,只是在该溶液中生成的碳酸钙少,溶剂多,生成极少量的碳酸钙在水中完全溶解,所以没有出现浑浊,故答案为:Ca(OH)2+CO2═CaCO3↓+H2O;B.
(2)①由图可知PH在不断变大,t1时PH为7,即溶液的酸性减弱,t1时变为中性,故答案为:溶液酸性减弱,t1时变为中性;
②判断发生酸和碱发生反应的依据是根据图中PH变化,利用温度在升高可判断反应是放热反应,故答案为:溶液PH增大,t1时PH=7;放热;
二、(1)因溶液为饱和溶液,且氢氧化钙的溶解度随温度的升高而减小,则在酒精灯上加热,有氢氧化钙析出而使溶液变浑浊,当放入盛冷水的烧杯中冷却降低温度时,溶解度变大,固体又溶解,则溶液变澄清,故答案为:氢氧化钙的溶解度随温度升高而减小;浑浊的石灰水变澄清;
(2)因二氧化碳能与澄清石灰水反应生成碳酸钙沉淀和水,则使溶液变浑浊,继续吹二氧化碳,则发生碳酸钙和水和二氧化碳生成能溶于水的碳酸氢钙,即反应为CaCO3+H2O+CO2═Ca(HCO3)2,则现象为先浑浊后变澄清,当对此溶液加热时发生Ca(HCO3)2
| ||
(3)因l:3的石灰水出现浑浊,则是发生Ca(OH)2+CO2═CaCO3↓+H2O反应,而1:7的石灰水不出现浑浊不出现浑浊,也发生了同样的反应,只是在该溶液中生成的碳酸钙少,溶剂多,生成极少量的碳酸钙在水中完全溶解,所以没有出现浑浊,故答案为:Ca(OH)2+CO2═CaCO3↓+H2O;B.
点评:本题属于实验探究习题,在探究碱的性质时学生应利用学过的碱的性质并结合习题中的信息来分析解答.

练习册系列答案
相关题目

 CaCO3↓+H2O+CO2↑;新配制饱和石灰水,做如下实验:
CaCO3↓+H2O+CO2↑;新配制饱和石灰水,做如下实验:
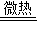 CaCO3↓+H2O+CO2↑;新配制饱和石灰水,做如下实验:
CaCO3↓+H2O+CO2↑;新配制饱和石灰水,做如下实验: