题目内容
在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案的设计、实施和评价.
①方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃).
测定某NaOH溶液的pH,pH
将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH,pH 小于7.
结论:稀H2SO4与NaOH溶液发生了化学反应,并且
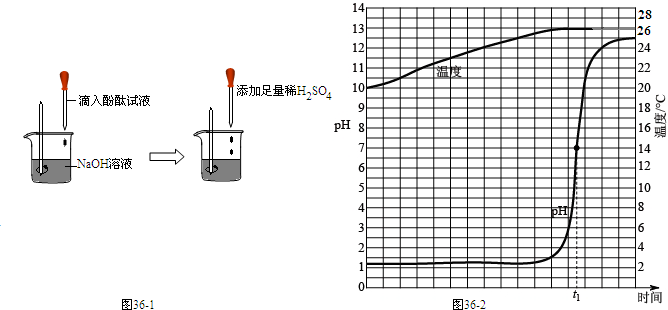
②方案二:观察到
(根据图示实验步骤,描述实验现象)

结论:稀H2SO4与NaOH溶液发生了化学反应,反映的化学方程式为
③实验室里还可以用稀硫酸与锌粒反应制取氢气,反应的化学方程式是
④为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是
①方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃).
测定某NaOH溶液的pH,pH
大于
大于
7(选填“大于”、“等于”或“小于”).将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH,pH 小于7.
结论:稀H2SO4与NaOH溶液发生了化学反应,并且
稀硫酸
稀硫酸
过量.②方案二:观察到
向滴有酚酞试液的氢氧化钠溶液中加入足量的稀硫酸,溶液由红色变为无色
向滴有酚酞试液的氢氧化钠溶液中加入足量的稀硫酸,溶液由红色变为无色
.(根据图示实验步骤,描述实验现象)

结论:稀H2SO4与NaOH溶液发生了化学反应,反映的化学方程式为
2NaOH+H2SO4═Na2SO4+2H2O
2NaOH+H2SO4═Na2SO4+2H2O
.③实验室里还可以用稀硫酸与锌粒反应制取氢气,反应的化学方程式是
Zn+H2SO4 ═ZnSO4+H2↑
Zn+H2SO4 ═ZnSO4+H2↑
.④为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是
放热
放热
(选填“放热”、“吸热”或“无热量变化”)的反应.分析:氢氧化钠溶液呈碱性,其pH大于7,能使酚酞试液变红,硫酸呈酸性,其pH小于7,不能使酚酞试液变色,氢氧化钠和硫酸反应能生成硫酸钠和水,该反应为放热反应.
解答:解:①氢氧化钠溶液呈碱性,其pH大于7,硫酸呈酸性,其pH小于7,氢氧化钠和硫酸反应后生成的硫酸钠溶液呈中性,而本题中测得反应后的溶液为酸性,说明稀硫酸过量;
②由图示可以看出,此实验为向滴有酚酞的氢氧化钠溶液中加入足量的稀硫酸,氢氧化钠和硫酸反应生成硫酸钠和水,根据酚酞在酸碱溶液中的颜色变化,可以观察到:向滴有酚酞试液的氢氧化钠溶液中加入足量的稀硫酸,溶液由红色变为无色,
结论:氢氧化钠溶液和稀硫酸反应生成了硫酸钠和水,该反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O;
③实验室里还可以用浓硫酸与锌粒反应制取氢气,该反应的化学方程式为:Zn+H2SO4 ═ZnSO4+H2↑;
④中和反应为放热反应,可以通过测定反应前后溶液的温度变化来进行确定,反应前测起始温度,反应中测温度是否升高,加入过量的硫酸再测溶液的温度是否降低.
故答案为:①大于;稀硫酸;
②向滴有酚酞试液的氢氧化钠溶液中加入足量的稀硫酸,溶液由红色变为无色;
结论:2NaOH+H2SO4═Na2SO4+2H2O;
③Zn+H2SO4 ═ZnSO4+H2↑;
④放热.
②由图示可以看出,此实验为向滴有酚酞的氢氧化钠溶液中加入足量的稀硫酸,氢氧化钠和硫酸反应生成硫酸钠和水,根据酚酞在酸碱溶液中的颜色变化,可以观察到:向滴有酚酞试液的氢氧化钠溶液中加入足量的稀硫酸,溶液由红色变为无色,
结论:氢氧化钠溶液和稀硫酸反应生成了硫酸钠和水,该反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O;
③实验室里还可以用浓硫酸与锌粒反应制取氢气,该反应的化学方程式为:Zn+H2SO4 ═ZnSO4+H2↑;
④中和反应为放热反应,可以通过测定反应前后溶液的温度变化来进行确定,反应前测起始温度,反应中测温度是否升高,加入过量的硫酸再测溶液的温度是否降低.
故答案为:①大于;稀硫酸;
②向滴有酚酞试液的氢氧化钠溶液中加入足量的稀硫酸,溶液由红色变为无色;
结论:2NaOH+H2SO4═Na2SO4+2H2O;
③Zn+H2SO4 ═ZnSO4+H2↑;
④放热.
点评:本题考查了酸碱中和反应,完成此题,可以依据已有的知识进行,所以要求同学们在平时的学习中加强基础知识的储备.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目