题目内容
【题目】某化学兴趣小组的同学对空气中氧气的含量测定进行再探究。

(一)甲组同学利用某脱氧剂测定空气中氧气含量,兴趣小组进行了如下实验:
使用图1装置进行实验.实验前应先进行的操作是 。
【实验过程】
步骤1:在注射器中放入足量脱氧剂粉末(体积为2mL),封闭。
步骤2:打开弹簧夹,将活塞向右拉至一定距离,关闭弹簧夹。
步骤3:不断轻轻晃动注射器,至活塞位置不再发生变化。
【数据处理】
(1)实验中需要记录的数据是:① 。
②反应后注射器活塞进入后显示剩余气体的体积。
(2)上述实验测定过程至少需要重复两次,其目的是 。
【实验对比】
实验室常通过燃烧红磷法测定空气中氧气的含量(装置如图2)。步骤如下:
(1)用弹簧夹夹紧橡皮管;
(2)点燃燃烧匙内的红磷,立即伸入瓶中并塞紧瓶塞。
(3) 。
(4)观察并记录水面的变化情况。
多次实验发现,集气瓶内上升的水面始终小于瓶内原有空气体积的。
【拓展研究】查阅资料得知,当空气中氧气的体积分数降至约为7%以下时,红磷不再燃烧.由此可知,燃烧红磷法测定结果不够准确。
【实验评价】与燃烧红磷法相比,脱氧剂法测定空气中氧气含量的优点是 。
(二)乙组同学利用装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%。
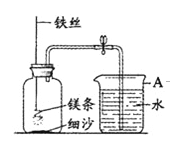
(1)如图中A仪器的名称是____________。
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 %。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有 。
【查阅资料】镁条在空气中燃烧,能与氧气反应产物为氧化镁(MgO)固体,也能与氮气反应产物为氮化镁(Mg3N2)固体。
(3)现有24g镁条,在空气中完全燃烧后,生成物的质量应在 (填数值范围)之间。
(请写出计算过程)
【答案】(一)检查装置的气密性 .
【数据处理】(1)注射器中原来的空气的体积(2)使测量的结果更准确(或者避免实验的偶然性)
【实验对比】(3)燃烧结束,冷却至室温。
【实验评价】不受氧气含量多少的影响,能充分消耗所有氧气,使结果更准确。
(二)(1)烧杯(2)21,氧气和氮气(3)33.3g--40g
【解析】
试题分析:(一)实验前应先进行的操作是检查装置的气密性;(1)注射器中原来的空气的体积(2)使测量的结果更准确(或者避免实验的偶然性)
【实验对比】(3)燃烧结束,冷却至室温。
【实验评价】不受氧气含量多少的影响,能充分消耗所有氧气,使结果更准确。
(二)(1)烧杯(2)氧气约占空气体积分数的21%,而氮气占78%,从而可判断只消耗氧气时,气体减少原体积的21%;而气体减少达70%时,大部分气体被消耗,说明减少的气体已不完全为氧气了,还应消耗了占空气78%的部分氮气;(3)设24g镁分别与氧气、氮气反应生成的氧化镁、氮化镁的质量分别为X、Y,2Mg~~2MgO 3Mg~~Mg3N2
48 80 72 100
24g X 24g Y
X=40g;Y=33.3g
由计算可知,24g镁在空气中完全燃烧后,生成物的质量大于33.3g,小于40g.33.3g--40g