题目内容
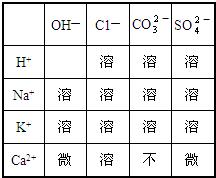
下表列出了20℃时“部分酸、碱、盐的溶解性”.请用化学用语回答下列各题.
(1)氢氧化钠在溶液中存在的粒子是
(2)在氢氧化钾与酸溶液的反应中,实质上参加反应的离子是
(3)从表中选择离子组成两种化合物,它们之间能发生反应生成气体.反应的化学方程式是
| OH- | Cl- | SO42- | CO32- | |
| H+ | - | 溶 | 溶 | 溶 |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| K+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 溶 | 溶 | 微 | 不 |
Na+、OH-
Na+、OH-
;(2)在氢氧化钾与酸溶液的反应中,实质上参加反应的离子是
H+、OH-
H+、OH-
;(3)从表中选择离子组成两种化合物,它们之间能发生反应生成气体.反应的化学方程式是
CaCO3+2HCl=CaCl2+H2O+CO2↑(答案不唯一,合理给分)
CaCO3+2HCl=CaCl2+H2O+CO2↑(答案不唯一,合理给分)
.分析:(1)根据氢氧化钠溶液的电离情况来回答;
(2)根据溶液中化学反应的实质是离子反应以及离子反应的条件判断;
(3)根据物质的性质和题意要求来书写方程式.
(2)根据溶液中化学反应的实质是离子反应以及离子反应的条件判断;
(3)根据物质的性质和题意要求来书写方程式.
解答:解:(1)氢氧化钠溶液的电离方程式为:NaOH═Na++OH-,故氢氧化钠在溶液中存在的粒子是Na+和OH-,所以本题答案为:Na+、OH-;
(2)氢氧化钾与酸溶液的反应为酸碱中和反应,其实质为氢氧根离子与氢离子结合成水分子的反应,所以本题答案为:H+、OH-;
(3)碳酸盐遇酸化气,所以可选用碳酸盐与酸的反应,所以本题答案为:Na2CO3+2HCl═2NaCl+CO2↑+H2O(表中其他碳酸盐和酸反应也可).
(2)氢氧化钾与酸溶液的反应为酸碱中和反应,其实质为氢氧根离子与氢离子结合成水分子的反应,所以本题答案为:H+、OH-;
(3)碳酸盐遇酸化气,所以可选用碳酸盐与酸的反应,所以本题答案为:Na2CO3+2HCl═2NaCl+CO2↑+H2O(表中其他碳酸盐和酸反应也可).
点评:本题考查了复分解反应的应用,完成此题,可以根据复分解反应的实质进行,此外要求同学们记住一些常见的物质的水溶性,以便能够准确的判断.

练习册系列答案
相关题目
下表列出了20℃时NaCl溶解实验的一组数据
下列叙述正确的是( )
| 实验序号 | 水的质量/g | 所加NaCl的质量/g | 所得溶液的质量/g |
| ① | 10 | 2 | 12 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 4 | 13.6 |
| ④ | 10 | 5 | 13.6 |
| A、①②所待溶液是20℃时NaCl的不饱和溶液 |
| B、①②③所得溶液是20℃时NaCl的不饱和溶液 |
| C、20℃时NaCl的溶解度为3.6g |
| D、①所得溶液的溶质的质量分数为20% |
下表列出了20℃时NaCl溶解实验的一组数据
根据上表并结合所学化学知识分析和回答下列问题:
(1)上述实验中, (填序号)得到的是不饱和溶液;
(2)20℃时NaCl的溶解度是 g;
(3)③与④所得溶液中溶质质量分数 (填“相同”或“不同”).
| 实验序号 | 水的质量/g | 所加NaCl的质量/g | 所得溶液的质量/g |
| ① | 10 | 2 | 12 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 4 | 13.6 |
| ④ | 10 | 5 | 13.6 |
(1)上述实验中,
(2)20℃时NaCl的溶解度是
(3)③与④所得溶液中溶质质量分数