题目内容
12、下表列出了20℃时“部分酸、碱、盐的溶解性”,试回答下列问题:
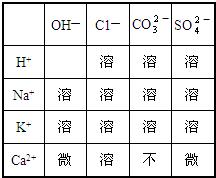
(1)表中的离子相互结合,形成的酸有(填名称)
(2)用化学符号填空.氢氧化钾溶液中存在的微粒有
(3)碳酸钠、碳酸钾的化学性质相似,是因为其溶液中都含有
(4)从表中选择离子组成两种化合物,它们之间能发生反应生成气体.反应的化学方程式为

(1)表中的离子相互结合,形成的酸有(填名称)
盐酸、碳酸、硫酸
;酸有相似的化学性质是因为酸溶液中都含有
氢离子(H+)
.(2)用化学符号填空.氢氧化钾溶液中存在的微粒有
K+、OH-、H2O
;在氢氧化钾与酸溶液的反应中,实质参加反应的离子是
H+和OH-
.(3)碳酸钠、碳酸钾的化学性质相似,是因为其溶液中都含有
碳酸根离子(CO32-)
.氯化钠溶液与硫酸钾溶液能否发生反应?不能
.理由是
因为离子之间不能结合生成沉淀、气体或水
.(4)从表中选择离子组成两种化合物,它们之间能发生反应生成气体.反应的化学方程式为
Na2CO3+2HCl═2NaCl+CO2↑+H2O(表中其他碳酸盐和酸反应也可)
,反应类型属于
复分解反应
.分析:根据复分解反应的条件,物质间若能结合成沉淀、气体或水,则物质不能共存.可以从复分解反应的条件入手完成此题.
解答:解:(1)根据表中提供的离子,可知能结合成的酸有盐酸、硫酸和碳酸,酸有相似的化学性质是因为酸溶液中都含有氢离子,所以本题答案为:盐酸、碳酸、硫酸,氢离子(H+);
(2)氢氧化钾可在水中电离出钾离子、氢氧根离子,此外还有水分子,氢氧化钾与酸溶液的反应为酸碱中和反应,其实质为氢氧根离子与氢离子结合成水分子的反应,所以本题答案为:K+、OH-、H2O,H+和OH-;
(3)碳酸钠和碳酸钾的溶液中都含有碳酸根离子,所以性质相似,氯化钠溶液与硫酸钾溶液电离出的离子不能结合成沉淀、气体或水,故不能发生反应,所以本题答案为:碳酸根离子(CO32-),不能,因为离子之间不能结合生成沉淀、气体或水;
(4)碳酸盐遇酸化气,所以可选用碳酸盐与酸的反应,所以本题答案为:Na2CO3+2HCl═2NaCl+CO2↑+H2O(表中其他碳酸盐和酸反应也可),复分解反应.
(2)氢氧化钾可在水中电离出钾离子、氢氧根离子,此外还有水分子,氢氧化钾与酸溶液的反应为酸碱中和反应,其实质为氢氧根离子与氢离子结合成水分子的反应,所以本题答案为:K+、OH-、H2O,H+和OH-;
(3)碳酸钠和碳酸钾的溶液中都含有碳酸根离子,所以性质相似,氯化钠溶液与硫酸钾溶液电离出的离子不能结合成沉淀、气体或水,故不能发生反应,所以本题答案为:碳酸根离子(CO32-),不能,因为离子之间不能结合生成沉淀、气体或水;
(4)碳酸盐遇酸化气,所以可选用碳酸盐与酸的反应,所以本题答案为:Na2CO3+2HCl═2NaCl+CO2↑+H2O(表中其他碳酸盐和酸反应也可),复分解反应.
点评:本题考查了复分解反应的应用,完成此题,可以根据复分解反应的实质进行,此外要求同学们记住一些常见的物质的水溶性,以便能够准确的判断.

练习册系列答案
相关题目
下表列出了20℃时NaCl溶解实验的一组数据
下列叙述正确的是( )
| 实验序号 | 水的质量/g | 所加NaCl的质量/g | 所得溶液的质量/g |
| ① | 10 | 2 | 12 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 4 | 13.6 |
| ④ | 10 | 5 | 13.6 |
| A、①②所待溶液是20℃时NaCl的不饱和溶液 |
| B、①②③所得溶液是20℃时NaCl的不饱和溶液 |
| C、20℃时NaCl的溶解度为3.6g |
| D、①所得溶液的溶质的质量分数为20% |
下表列出了20℃时NaCl溶解实验的一组数据
根据上表并结合所学化学知识分析和回答下列问题:
(1)上述实验中, (填序号)得到的是不饱和溶液;
(2)20℃时NaCl的溶解度是 g;
(3)③与④所得溶液中溶质质量分数 (填“相同”或“不同”).
| 实验序号 | 水的质量/g | 所加NaCl的质量/g | 所得溶液的质量/g |
| ① | 10 | 2 | 12 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 4 | 13.6 |
| ④ | 10 | 5 | 13.6 |
(1)上述实验中,
(2)20℃时NaCl的溶解度是
(3)③与④所得溶液中溶质质量分数
