题目内容
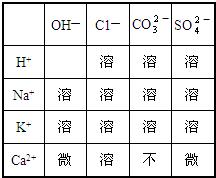
29、下表列出了20℃时“部分酸、碱、盐的溶解性”,试回答下列问题:

(1)表中的离子相互结合,形成的酸有(填名称)
(2)在氢氧化钾与酸溶液反应时,实质上参加反应的离子是(填符号)
写出氢氧化钾与一种酸反应的化学方程式:
(3)碳酸钠、碳酸钾的化学性质相似,是因为其溶液中都含有(填符号)
(4)选择表中离子组成两对化合物使其反应(反应物不能重复),按要求写出化学方程式:
反应后生成气体的:

(1)表中的离子相互结合,形成的酸有(填名称)
盐酸、碳酸、硫酸
;酸具有相似的化学性质是因为酸溶液中都含有(填符号)
H+
;(2)在氢氧化钾与酸溶液反应时,实质上参加反应的离子是(填符号)
H+和OH-
,写出氢氧化钾与一种酸反应的化学方程式:
KOH+HCl=KCl+H2O
,该反应类型为
复分解反应
;(3)碳酸钠、碳酸钾的化学性质相似,是因为其溶液中都含有(填符号)
CO32-
;(4)选择表中离子组成两对化合物使其反应(反应物不能重复),按要求写出化学方程式:
反应后生成气体的:
2HCl+K2CO3=2KCl+H2O+CO2↑
.分析:(1)根据酸的概念,酸中有氢离子和酸根离子;具有相似化学性质的原因是它们有相同的氢离子;
(2)酸与碱能发生反应是因生成了水,则实际参加反应的离子和水的生成有关,该反应符合复分解反应的条件;
(3)根据碳酸钠、碳酸钾的构成可以找出相同的离子,是它们化学性质相似的原因;
(4)根据表格中提供的离子,反应后生成气体的应为碳酸盐与酸的反应,能生成二氧化碳气体.
(2)酸与碱能发生反应是因生成了水,则实际参加反应的离子和水的生成有关,该反应符合复分解反应的条件;
(3)根据碳酸钠、碳酸钾的构成可以找出相同的离子,是它们化学性质相似的原因;
(4)根据表格中提供的离子,反应后生成气体的应为碳酸盐与酸的反应,能生成二氧化碳气体.
解答:解:(1)表格中第一行可组成酸,氢离子与酸根离子结合成酸(氢氧根离子除外),且它们都有共同的氢离子,则它们有相似的化学性质,故答案为:盐酸、碳酸、硫酸;H+.
(2)因酸碱反应有水生成是该反应能发生的条件,则反应实质为H+和OH-结合生成水,如氢氧化钾与盐酸反应生成氯化钾和水,符合化合物与化合物相互交换成分反应生成化合物与化合物,则属于复分解反应,故答案为:H+和OH-;KOH+HCl=KCl+H2O;复分解反应.
(3)碳酸钠、碳酸钾中都含有碳酸根,则在它们的溶液中都有碳酸根离子,故答案为:CO32-.
(4)由表可知,碳酸盐与酸的反应,能生成二氧化碳气体,故答案为:2HCl+K2CO3=2KCl+H2O+CO2↑.
(2)因酸碱反应有水生成是该反应能发生的条件,则反应实质为H+和OH-结合生成水,如氢氧化钾与盐酸反应生成氯化钾和水,符合化合物与化合物相互交换成分反应生成化合物与化合物,则属于复分解反应,故答案为:H+和OH-;KOH+HCl=KCl+H2O;复分解反应.
(3)碳酸钠、碳酸钾中都含有碳酸根,则在它们的溶液中都有碳酸根离子,故答案为:CO32-.
(4)由表可知,碳酸盐与酸的反应,能生成二氧化碳气体,故答案为:2HCl+K2CO3=2KCl+H2O+CO2↑.
点评:学生应根据酸的概念来理解其溶液中的离子,利用复分解反应发生的条件来判断反应的发生并能书写相关的化学方程式.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下表列出了20℃时NaCl溶解实验的一组数据
下列叙述正确的是( )
| 实验序号 | 水的质量/g | 所加NaCl的质量/g | 所得溶液的质量/g |
| ① | 10 | 2 | 12 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 4 | 13.6 |
| ④ | 10 | 5 | 13.6 |
| A、①②所待溶液是20℃时NaCl的不饱和溶液 |
| B、①②③所得溶液是20℃时NaCl的不饱和溶液 |
| C、20℃时NaCl的溶解度为3.6g |
| D、①所得溶液的溶质的质量分数为20% |
下表列出了20℃时NaCl溶解实验的一组数据
根据上表并结合所学化学知识分析和回答下列问题:
(1)上述实验中, (填序号)得到的是不饱和溶液;
(2)20℃时NaCl的溶解度是 g;
(3)③与④所得溶液中溶质质量分数 (填“相同”或“不同”).
| 实验序号 | 水的质量/g | 所加NaCl的质量/g | 所得溶液的质量/g |
| ① | 10 | 2 | 12 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 4 | 13.6 |
| ④ | 10 | 5 | 13.6 |
(1)上述实验中,
(2)20℃时NaCl的溶解度是
(3)③与④所得溶液中溶质质量分数