题目内容
(10分)在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)
进行反应,有白色沉淀产生,过滤后得到澄清滤液。同学们对该实验进行了一系列的探究。
Ⅰ.定性探究:
探究一:M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:
①是 ,
②是CaCl2.
【收集资料】CaCl2水溶液呈中性。
(2)【设计实验】同学们设计了如下方案并进行实验:
探究二过滤后澄清滤液中会有哪些溶质?
【提出猜想】猜想一:NaOH 和Na2CO3 ;
猜想二: ;
猜想三:NaOH 。
(3)【实验验证】同学们经过交流讨论,设计以下实验方案确定滤液中溶质的组成:
Ⅱ.定量探究:
【提出问题】过滤后澄清滤液中NaOH的质量分数是多少?
【设计实验】
小明同学取100g过滤后澄清滤液于烧杯中,向烧杯中逐滴加入过量的稀盐酸,产生的气体与所加入稀盐酸质量关系如下图所示:计算过滤后澄清滤液中NaOH的质量分数是多少?(请列出计算过程)
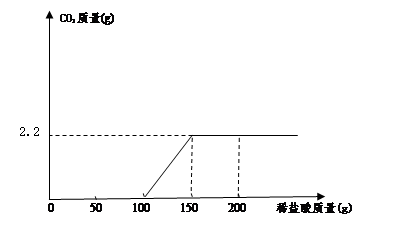
进行反应,有白色沉淀产生,过滤后得到澄清滤液。同学们对该实验进行了一系列的探究。

Ⅰ.定性探究:
探究一:M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:
①是 ,
②是CaCl2.
【收集资料】CaCl2水溶液呈中性。
(2)【设计实验】同学们设计了如下方案并进行实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴加 | | 猜想①正确。碳酸钠与其反应的化学方程式为 |
探究二过滤后澄清滤液中会有哪些溶质?
【提出猜想】猜想一:NaOH 和Na2CO3 ;
猜想二: ;
猜想三:NaOH 。
(3)【实验验证】同学们经过交流讨论,设计以下实验方案确定滤液中溶质的组成:
| 实验操作 | 实验现象 | 实验结论 |
| 分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液, B中加入 溶液 | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
| | “猜想二”成立 | |
| | “猜想三”成立 |
Ⅱ.定量探究:
【提出问题】过滤后澄清滤液中NaOH的质量分数是多少?
【设计实验】
小明同学取100g过滤后澄清滤液于烧杯中,向烧杯中逐滴加入过量的稀盐酸,产生的气体与所加入稀盐酸质量关系如下图所示:计算过滤后澄清滤液中NaOH的质量分数是多少?(请列出计算过程)
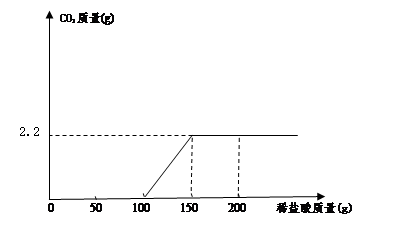
Ⅰ.定性探究:
(1)氢氧化钙 (2)无色酚酞 溶液变红 Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
探究二:猜想二 NaOH和Ca(OH)2 (3)Na2CO3 若A中没有沉淀,B中产生白色沉淀
若A、B两支试管中都没有沉淀产生
Ⅱ.定量探究: 7.3% 8%
(1)氢氧化钙 (2)无色酚酞 溶液变红 Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
探究二:猜想二 NaOH和Ca(OH)2 (3)Na2CO3 若A中没有沉淀,B中产生白色沉淀
若A、B两支试管中都没有沉淀产生
Ⅱ.定量探究: 7.3% 8%
试题分析Ⅰ.定性探究:(1)根据残缺标签,以及将碳酸钠溶液和一瓶标签破损的溶液M进行反应,有白色沉淀产生,可猜想溶液M是氢氧化钙
(2)如果猜想①正确,氢氧化钙溶液显碱性,所以取少量M溶液于试管中,向其中滴加无色酚酞,可观察到溶液变红,说明是氢氧化钙,那么发生的反应是:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
探究二:要探究反应后溶液中溶质的成分,反应后的生成物一定有,反应物可能有,即可能过量,所以猜想二是:NaOH和Ca(OH)2,
(3)分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液,B中加入Na2CO3溶液,若A中产生白色沉淀,B中没有沉淀,“猜想一”成立;若A中没有沉淀,B中产生白色沉淀,“猜想二”成立;若A、B两支试管中都没有沉淀产生,“猜想三”成
解:设所用盐酸中溶质的质量分数为X
Na2CO3 + 2HCl ="2NaCl" + H2O + CO2↑
73 44
 50g·X 2.2g
50g·X 2.2g
X = 7.3% (1分)
设滤液中NaOH的质量为Y
NaOH + HCl =" NaCl" + H2O
40 36.5
Y 100g×7.3%

Y = 8g
NaOH% =
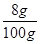 ×100% = 8% (1分)2CO3的化学性质,根据化学方程式进行计算
×100% = 8% (1分)2CO3的化学性质,根据化学方程式进行计算
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目