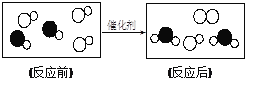题目内容
【题目】在“质量守恒定律”的课堂教学中,甲、乙、丙、丁四个组的同学分别做了A、B、C、D四个实验,他们都进行了规范的操作、准确的称量和细致的观察。
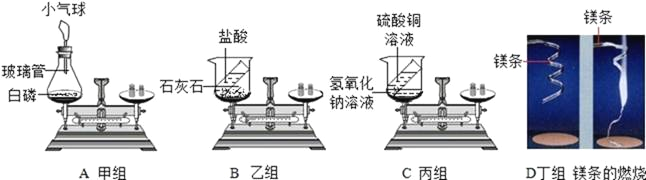
(1)A实验:在实验过程中观察到气球的变化是_____,产生该现象的原因是:___。
(2)A、B、C、D四个实验中,化学反应前后一定没有发生改变的是_____(填序号)。
①元素的种类 ②元素的化合价 ③物质的总质量
④物质的种类 ⑤原子的个数 ⑥原子的质量
(3)丙组同学认为C实验说明了质量守恒。反应为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,请你从原子的角度说明守恒的原因:_______。
(4)乙、丁两组同学得到的错误结论是“B实验说明质量不守恒”。老师引导学生分析了B、D两个实验的原因。你认为B实验不平衡的原因是________;实验D中镁燃烧化学方程式____,理论上镁条燃烧后的质量应该比反应前增重,原因是______。
(5)通过上述实验,你得到的启示:有气体参加或生成的反应,在验证质量守恒定律时应该在_____装置中进行实验。
【答案】先膨胀后缩小 白磷燃烧放热,导致瓶内气压增大,白磷完全反应后消耗氧气,并且温度降低 ①③⑤⑥ 反应前后原子种类、总个数和质量都不变 反应生成的二氧化碳逸出装置 2Mg+O2![]() 2MgO 氧气参加了反应 密封
2MgO 氧气参加了反应 密封
【解析】
(1)A实验:在实验过程中观察到气球的变化是先膨胀后缩小,故填先膨胀后缩小;产生该现象的原因是:白磷燃烧放热,导致瓶内气压增大,气球变大;白磷完全反应后消耗氧气,并且温度降低,气球变小,故填白磷燃烧放热,导致瓶内气压增大,白磷完全反应后消耗氧气,并且温度降低。
(2)A、B、C、D四个实验中化学反应前后:①元素的种类一定不变;②元素的化合价可能改变;③物质的总质量一定不变;④物质的种类一定改变;⑤原子的个数一定不变:⑥原子的质量一定不变,故填①③⑤⑥。
(3)守恒的原因:化学反应前后,原子种类、总个数和质量都不变,所以化学反应前后物质的总质量不变,故填反应前后原子种类、总个数和质量都不变;
(4)B实验不平衡的原因是反应在开放容器中进行,生成的二氧化碳逸出装置,故填反应生成的二氧化碳逸出装置;
实验D中镁与氧气在点燃的条件下反应生成氧化镁,故反应的化学方程式写为:2Mg+O2![]() 2MgO;
2MgO;
理论上镁条燃烧后的质量应该比反应前增重,原因是氧气参加了反应,故填氧气参加了反应。
(5)通过上述实验,得到的启示:有气体参加或生成的反应,在验证质量守恒定律时应该在密封装置中进行实验,故填密封。

 阅读快车系列答案
阅读快车系列答案【题目】在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是( )
物 质 | M | N | Q | P |
反应前质量(g) | 18 | 1 | 2 | 32 |
反应后质量(g) | X | 26 | 2 | 12 |
A.反应后物质M的质量为l3gB.该变化的基本反应类型是分解反应
C.反应中N、P的质量比为5:4D.物质Q一定是该反应的催化剂