题目内容
【题目】实验是学习化学的一个重要途径。
(1)根据下图回答问题。
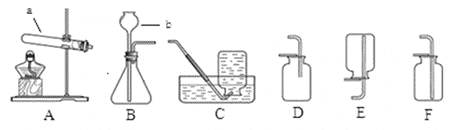
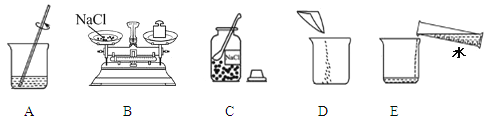
①仪器a的名称是 。
②实验室用高锰酸钾制取氧气时,所选用的发生装置是 (填字母序号,下同),收集装置
是 或E。写出该反应的化学方程式 。
(2)实验室配制50g 5%的氯化钠溶液的操作示意图如图所示。其中玻璃棒的作用是 。该实验的正确操作顺序为 (填字母序号)。
(3)实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体.请完成下列问题:
①反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为 g.
②计算原过氧化氢溶液中溶质的质量分数.
【答案】(1)集气瓶 A C 2KMnO4![]() K2MnO4+MnO2+O2↑(2)加快溶解速度 C B D E A
K2MnO4+MnO2+O2↑(2)加快溶解速度 C B D E A
(3)2.5g 3.4%
【解析】
试题分析:实验室用高锰酸钾制取氧气时,需要加热所选用的发生装置是A,配制溶液时玻璃棒的作用是加快溶解速度,二氧化锰是催化剂反应前后质量不会发生变化,设溶液中过氧化氢的质量是x,2H2O2 ![]() 2H2O +O2↑
2H2O +O2↑
68 32
X 1.6克
列比例式得:68:x=32:1.6克 解得X=3.4克 所以原过氧化氢溶液中溶质的质量分数=3.4克/100×100%=3.4%。

【题目】(19分)金属材料在生产、生活中的应用非常广泛。
(1)吃火锅用的锅体是由铜合金制造的,主要是因为铜合金具有很好的 (填序号)。
A.导电性 B.导热性 C.延展性
(2)金属锈蚀造成浪费。铁制品锈蚀的过程,实际上是铁与空气中的 和 发生化学反应的过程。
(3)目前世界上已有50%以上的废钢铁得到回收利用,其目的是 。
A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈
(4)金属是一种重要的材料,人类的生活和生产都离不开金属。下表表示了金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致年限。
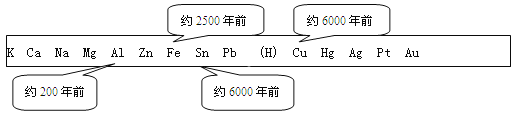
根据图中数据和有关的化学知识,你认为金属大规模开发、利用的先后顺序跟下列 有关。
①地壳中金属元素的含量;
②金属的导电性;
③金属的活动性;
④金属的延展性;
⑤金属冶炼的难易程度。
(5)实验室有锌片、铁片、铜片、稀硫酸、硫酸锌溶液、硫酸亚铁溶液和硫酸铜溶液7种物质,小红选择合适的物质,设计了以下三种方法对锌、铜、铁的金属活动性顺序进行验证。
①方法一所选用的3种物质是 、硫酸锌溶液和硫酸铜溶液。
②方法二所选用的3种物质是锌片、铜片和 。
③方法三所选用4种物质是锌片、铁片、铜片和 。
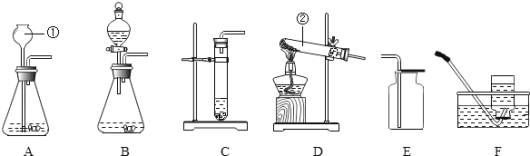
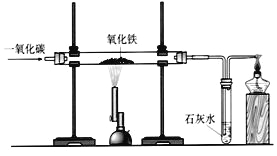
(6)炼铁的原理是利用一氧化碳与氧化铁反应,其反应的化学方程式为 。在实验室里,可用下图所示装置进行实验:实验中玻璃管内的粉末由红色色变黑色,红色粉末氧化铁中的铁元素的化合价为 。
(7)某钢铁厂每天需消耗5 000 t含Fe2O3 80%的赤铁矿石,该厂理论上可日产含Fe 98%的生铁 t。(计算结果保留1位小数)
(8)某兴趣小组的同学对一批铁的样品(含有杂质,杂质不溶与水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中一位同学所用的稀硫酸与铁样品恰好完全反应,实验数据如表:
甲 | 乙 | 丙 | |
烧杯+稀硫酸的质量 | 200 | 150 | 150 |
加入铁的样品的质量 | 9 | 9 | 14 |
充分反应后,烧杯+剩余物的质量 | 208、7 | 158、7 | 163、7 |
请你认真分析数据,回答下列问题:
① 同学所用的稀硫酸与铁的样品恰好完全反应?
②计算铁的样品中铁的质量分数。(写出详细的计算过程)
【题目】在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质质量如下表:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量(g) | 4 | 1 | 42 | 10 |
反应后质量(g) | 待测 | 20 | 6 | 31 |
完全反应后,甲的“待测”值应为
A.10 B.8 C.4 D. 0
【题目】(13分)某化学课外活动小组在实验室配制石灰水时,因发现烧杯底部有固体未溶解,对熟石灰样品的主要成分进行了探究.请你参与讨论并完成实验报告.
【提出问题】针对该熟石灰样品的成分,同学们展开了讨论,小明认为溶解后剩余固体为变质后的难溶性物质,变质的化学方程式为 。小华同学不同意他的判断,你认为小华同学的理由是 。
【进行猜想】猜想一:熟石灰样品成分是Ca(OH)2;
猜想二:熟石灰样品成分是CaCO3;
猜想三:你认为熟石灰样品成分还可能是 。
【实验与结论】请你通过实验验证你的猜想:
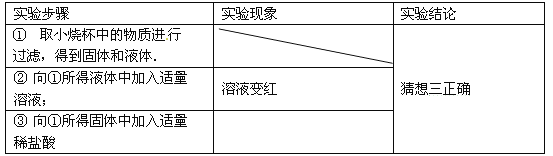
【拓展与应用】实验小组同学想测定样品中Ca(OH)2的质量分数:称取上述0.5g样品,加足量水使之充分溶解,搅拌后过滤.
①甲组在实验室用pH试纸和配制好的10%盐酸溶液进行实验,实验数据记录见下表.(提示:氯化钙溶液呈中性)
加入盐酸溶液的质量/g | 0 | 2.5 | 3.65 | 6 |
样品的pH | 12 | 11 | 7 | 2 |
I.边滴加稀盐酸,边不断搅拌的目的是 ;
II.样品中Ca(OH)2的质量分数是多少?(写出计算过程,4分)
②乙组同学进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图象如下图.则图中a点表示的含义是 ;
图中b点溶液中含有的溶质有 (填化学式),乙组同学要计算出样品中氢氧化钙的质量分数,除了要用到已有数据外,你认为还需要的数据是 。