题目内容
【题目】(13分)某化学课外活动小组在实验室配制石灰水时,因发现烧杯底部有固体未溶解,对熟石灰样品的主要成分进行了探究.请你参与讨论并完成实验报告.
【提出问题】针对该熟石灰样品的成分,同学们展开了讨论,小明认为溶解后剩余固体为变质后的难溶性物质,变质的化学方程式为 。小华同学不同意他的判断,你认为小华同学的理由是 。
【进行猜想】猜想一:熟石灰样品成分是Ca(OH)2;
猜想二:熟石灰样品成分是CaCO3;
猜想三:你认为熟石灰样品成分还可能是 。
【实验与结论】请你通过实验验证你的猜想:
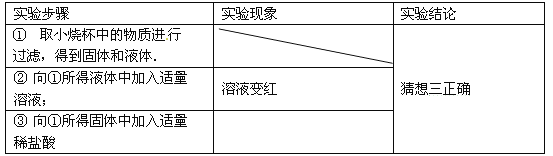
【拓展与应用】实验小组同学想测定样品中Ca(OH)2的质量分数:称取上述0.5g样品,加足量水使之充分溶解,搅拌后过滤.
①甲组在实验室用pH试纸和配制好的10%盐酸溶液进行实验,实验数据记录见下表.(提示:氯化钙溶液呈中性)
加入盐酸溶液的质量/g | 0 | 2.5 | 3.65 | 6 |
样品的pH | 12 | 11 | 7 | 2 |
I.边滴加稀盐酸,边不断搅拌的目的是 ;
II.样品中Ca(OH)2的质量分数是多少?(写出计算过程,4分)
②乙组同学进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图象如下图.则图中a点表示的含义是 ;
图中b点溶液中含有的溶质有 (填化学式),乙组同学要计算出样品中氢氧化钙的质量分数,除了要用到已有数据外,你认为还需要的数据是 。

【答案】【提出问题】Ca(OH)2 + CO2==== CaCO3 ↓+ H2O;Ca(OH)2微溶于水;【进行猜想】Ca(OH)2和CaCO3【实验与结论】②酚酞;③有气泡;【拓展与应用】①Ⅰ加快反应速率;
Ⅱm(HCl)=3.65g×10%=0.365g;
设的质量为x
Ca(OH)2+2HCl=CaCl2+2H2O Ca(OH)2
74 73
x 0.365g
74/x=73/0.365g x=0.37g
Ca(OH)2%=0.37g/0.5g×100%=74%
②与稀盐酸恰好反应完全,溶液变成中性;CaCl2和HCl;盐酸的浓度和密度。
【解析】
试题分析:【提出问题】略;熟石灰为Ca(OH)2微溶于水,因此固体除了不能溶解的CaCO3还可能有未溶解的Ca(OH)2;【进行猜想】控制变量,变量为Ca(OH)2和CaCO3,因此第三个猜想就是Ca(OH)2和CaCO3混合;【实验与结论】猜想三正确,那么Ca(OH)2和CaCO3都含有,Ca(OH)2具有碱性,由现象变红就是和无色酚酞;CaCO3能和稀盐酸反应有CO2气体生成,以此来检测CaCO3存在;【拓展与应用】①Ⅰ搅拌可以加快反应速率;Ⅱ Ca(OH)2的质量分数= Ca(OH)2的质量/样品总质量0.5g×100%,那么就须求出Ca(OH)2的质量,可以通过Ca(OH)2和HCl的反应方程式和m(HCl)来求得;②a点是pH=7为中性,那么碱性的Ca(OH)2和酸性的HCl刚才完全中和;b点pH﹤7为酸性,说明Ca(OH)2完全反应后还加入了多余的HCl,那么溶质就有CaCl2和HCl;知道盐酸的浓度才能知道参与反应的HCl的质量,才能通过化学方程式求的Ca(OH)2的质量。