题目内容
某化学课外活动小组的同学利用课堂所学化学知识,欲用一定量的石灰石、水、纯碱为原料制取烧碱,主要步骤如下图所示:
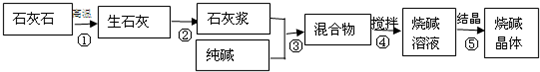
(1)写出的化学方程式并判断反应类型:
步骤①______,属于______反应.步骤③______,属于______反应.
(2)步骤④的操作是______,步骤⑤采用的结晶方法是______.
(3)步骤①中碳酸钙煅烧一段时间后,同学们想证明得到的白色固体是否全部转变成了生石灰?甲、乙两位同学分别提出了验证方案:
| 实验操作 | 实验现象 | 结论 | |
| 甲 | 取样于试管中,滴加少量稀盐酸 | 看有没有无色气泡产生 | 若有气泡,证明尚有碳酸钙未分解完,反之则无 |
| 乙 | 取样于试管中,加入适量水,振荡 | 看有没有白色固体不溶解 | 若有白色固体不溶解,证明尚有碳酸钙未分解完,反之则无 |
(4)若使用药品均无杂质,且实验过程中无损耗,若想制取100g烧碱,至少需要纯碱______g.
解:(1)碳酸钙高温能分解能生成氧化钙和二氧化碳,反应的方程式为CaCO3 CaO+CO2↑,属于分解反应;
CaO+CO2↑,属于分解反应;
氢氧化钙能与碳酸钠反应生成氢氧化钠和碳酸钙,反应的方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,属于复分解反应;
(2)要将不溶性固体和液体分离,可以使用过滤的方法;要从溶液中分离出可溶性固体,可以使用蒸发结晶的方法;
(3)甲实验中有气泡冒出,碳酸钙和盐酸反应生成二氧化碳,说明有二氧化碳气体放出,所以若有气泡,证明尚有碳酸钙未分解完,反之则无;而乙实验中生石灰放入水中产生的熟石灰微溶,也会有较多固体不溶,无法判别结论;
(4)设需要纯碱的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 80
x 100g

x=132.5g
答:至少需要纯碱132.5g.
故答案为:(1)①CaCO3 CaO+CO2↑,属于分解反应;③Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,属于复分解反应;
CaO+CO2↑,属于分解反应;③Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,属于复分解反应;
(2)过滤; 蒸发;
(3)甲; 因生石灰放入水中产生的熟石灰微溶,也会有较多固体不溶,无法判别结论;
(4)132.5g.
分析:(1)根据已有的知识进行分析,碳酸钙高温能分解能生成氧化钙和二氧化碳,氢氧化钙能与碳酸钠反应生成氢氧化钠和碳酸钙;
(2)要将不溶性固体和液体分离,可以使用过滤的方法;要从溶液中分离出可溶性固体,可以使用蒸发结晶的方法;
(3)根据碳酸钙和盐酸反应生成二氧化碳以及氢氧化钙微溶于水进行解答;
(4)根据化学方程式进行解答.
点评:不同考查了碳酸钙、氧化钙以及氢氧化钙的有关计算,完成此题,可以依据已有的知识结合题干提供的信息进行.
 CaO+CO2↑,属于分解反应;
CaO+CO2↑,属于分解反应;氢氧化钙能与碳酸钠反应生成氢氧化钠和碳酸钙,反应的方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,属于复分解反应;
(2)要将不溶性固体和液体分离,可以使用过滤的方法;要从溶液中分离出可溶性固体,可以使用蒸发结晶的方法;
(3)甲实验中有气泡冒出,碳酸钙和盐酸反应生成二氧化碳,说明有二氧化碳气体放出,所以若有气泡,证明尚有碳酸钙未分解完,反之则无;而乙实验中生石灰放入水中产生的熟石灰微溶,也会有较多固体不溶,无法判别结论;
(4)设需要纯碱的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 80
x 100g

x=132.5g
答:至少需要纯碱132.5g.
故答案为:(1)①CaCO3
 CaO+CO2↑,属于分解反应;③Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,属于复分解反应;
CaO+CO2↑,属于分解反应;③Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,属于复分解反应;(2)过滤; 蒸发;
(3)甲; 因生石灰放入水中产生的熟石灰微溶,也会有较多固体不溶,无法判别结论;
(4)132.5g.
分析:(1)根据已有的知识进行分析,碳酸钙高温能分解能生成氧化钙和二氧化碳,氢氧化钙能与碳酸钠反应生成氢氧化钠和碳酸钙;
(2)要将不溶性固体和液体分离,可以使用过滤的方法;要从溶液中分离出可溶性固体,可以使用蒸发结晶的方法;
(3)根据碳酸钙和盐酸反应生成二氧化碳以及氢氧化钙微溶于水进行解答;
(4)根据化学方程式进行解答.
点评:不同考查了碳酸钙、氧化钙以及氢氧化钙的有关计算,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



