题目内容
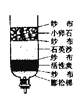
【题目】工业上用铁矿石炼铁炼钢和轧制钢材的主要流程如下图
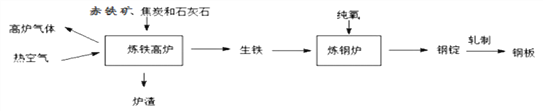
⑴工业炼铁的固体原料需经过粉碎,其目的是_______。
⑵铁高炉中焦炭的作用:①提供高温;②_________(用化学方程式表示);
⑶高炉炼铁原理的化学方程式是_________。是否属于置换反应的_______(填“是”或“否”)。
⑷钢的含碳量为 0.03%-2%,生铁的含碳量为_______。生铁的硬度_______(填“>”、“<”或“=”)纯铁。
⑸生铁炼钢的反应原理是:_______(用化学方程式表示)。将钢锭轧成钢板,体现了金属的______性。
⑹炉渣中含有硅酸钙(CaSiO3),其中硅元素的化合价是___________。
⑺工业上常用稀盐酸除铁锈,写出该反应的化学方程式_______________。
【答案】 增大反应物接触面积,加快反应速率 C+CO2![]() 2CO Fe2O3+3CO
2CO Fe2O3+3CO![]() 2Fe+3CO2 否 2%-4.3% > C+O2
2Fe+3CO2 否 2%-4.3% > C+O2![]() CO2 延展 +4 6HCl + Fe2O3=2FeCl3+3H2O
CO2 延展 +4 6HCl + Fe2O3=2FeCl3+3H2O
【解析】(1)炼铁的固体原料需经过粉碎,粉碎的目的是增大反应物接触面积,加快反应速率;(2)在高温的条件下碳与二氧化碳反应生成一氧化碳;该反应的化学方程式:C+CO2![]() 2CO;(3)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO
2CO;(3)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;该反应的反应物均是化合物,不属于置换反应;(4)生铁的含碳量为2%-4.3%,合金的硬度大于组成金属的硬度;(5)生铁炼钢就是降低碳的含量,碳与氧气在点燃的条件下反应生成二氧化碳,将钢锭轧成钢板,体现了金属的延展性;反应的化学方程式:C+O2
2Fe+3CO2;该反应的反应物均是化合物,不属于置换反应;(4)生铁的含碳量为2%-4.3%,合金的硬度大于组成金属的硬度;(5)生铁炼钢就是降低碳的含量,碳与氧气在点燃的条件下反应生成二氧化碳,将钢锭轧成钢板,体现了金属的延展性;反应的化学方程式:C+O2![]() CO2;(6)钙元素显+1价,氧元素显-2价,设硅元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+x+(-2)×3=0,则x=+4价;(7)铁锈的主要成分是氧化铁,氧化铁与与盐酸反应生成氯化铁和水,该反应的化学方程式:Fe2O3+6HCl=2FeCl3+3H2O。
CO2;(6)钙元素显+1价,氧元素显-2价,设硅元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+x+(-2)×3=0,则x=+4价;(7)铁锈的主要成分是氧化铁,氧化铁与与盐酸反应生成氯化铁和水,该反应的化学方程式:Fe2O3+6HCl=2FeCl3+3H2O。