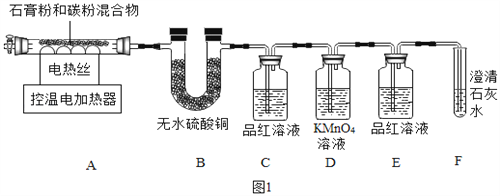
题目内容
【题目】神舟十一号与天宫二号的成功对接增强了国人的民族自信,推动了相关领域的研究。
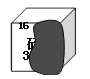
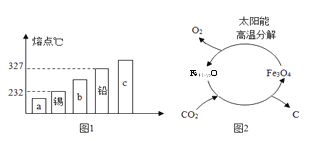
⑴ 合金材料的研发 ①合金的很多性能与组成它们的纯金属不同。图1能表示锡铅合金的是_________(填序号“a”“b”或“c”)。
②镁合金被誉为“21世纪绿色金属结构材料”。该合金是一种储氢材料,完全吸氢后得到MgH2和Al,“储氢过程”属于________(填“物理”或“化学”)变化。
⑵ 合成材料的改良:碱式碳酸铝镁[MgaAlb(OH)c(CO3)dxH2O]是一种新型塑料阻燃剂,其中a、b、c、d的代数关系式:2a+3b=_________。
⑶ CO2的绿色利用:①目前空间站处理CO2的一种方法是在催化剂作用下,利用H2使CO2转化为甲烷并得到生活用水。该反应的化学方程式为__________。②以“铁氧化物”为催化剂,利用太阳能将CO2热解为碳和氧气,这一转化过程(如图2)中化合价升高的非金属元素是_________。
【答案】 a 化学 c+2d 4H2+CO2 ![]() CH4+2H2O 氧元素
CH4+2H2O 氧元素
【解析】(1)①锡铅合金的熔点比锡、铅的熔点低,因此图1能表示锡铅合金的是a;②储氢过程”中生成了新物质MgH2和Al,属于化学变化;
(2)根据化合物中元素化合价代数和为零有:(+2)a+(+3)b+(-1)c+(-2)d=0,即2a+3b=c+2d;
(3)①在催化剂作用下,H2与CO2反应生成甲烷和水,该反应的化学方程式为:4H2+CO2 ![]() CH4+2H2O;②CO2热解为碳和氧气,碳元素化合价由+4变成0,氧元素化合价由-2变成0,这一转化过程中化合价升高的非金属元素是氧元素。
CH4+2H2O;②CO2热解为碳和氧气,碳元素化合价由+4变成0,氧元素化合价由-2变成0,这一转化过程中化合价升高的非金属元素是氧元素。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】某兴趣小组在制取氧气的实验过程中,有同学联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,于是做出猜想:过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应_____(填“能”或“不能”)用于实验室制取氧气。
【分析与反思】
(1)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议_____。
(2)同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气。你认为猜想_____(填序号)一定是错误的,理由是_____