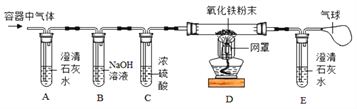
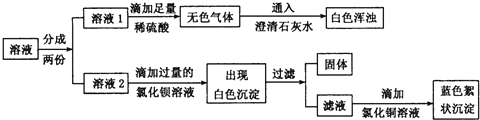
题目内容
【题目】城市生活垃圾的处理是世界性难题,某垃圾处理厂对生活垃圾进行处理与综合 利用部分流程如下:
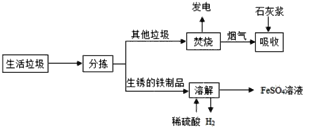
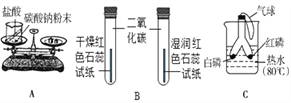
资料 1:垃圾焚烧产生的烟气中含有 SO2、HCl 等有害气体。 资料 2:+2 价的铁元素容易被空气中的氧气氧化。
资料 3:Fe 与 Fe2(SO4)3 反应生成 FeSO4。 回答下列问题:
(1)发电厂是利用垃圾焚烧产生的_____转变成电能;
(2)写出吸收步骤中属于中和反应的化学方程式_____;
(3)溶解步骤中,生锈的铁制品在足量的稀硫酸中充分反应后有黑色固体剩余,其主要成分是_____(写化学式);
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,其中氮气的作用是_____;
(5)请你就合肥市生活垃圾处理提一条建议_______。
【答案】 热能 2HCl+Ca(OH)2=CaCl2+2H2O C 保护气,避免+2 价的铁元素被空气中氧气氧化 垃圾分类回收等
【解析】(1)发电厂是利用垃圾焚烧产生的热能转变成电能;(2)中和反应是指酸和碱生成盐和水的反应。如:2HCl+Ca(OH)2=CaCl2+2H2O;(3)生铁是铁的合金,主要杂质是碳,碳不能与酸反应,生锈的铁制品在足量的稀硫酸中充分反应后有黑色固体剩余,其主要成分是C;(4)硫酸亚铁能与氧气反应生成硫酸铁,将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,其中氮气的作用是做保护气,隔绝氧气,避免+2 价的铁元素被空气中氧气氧化;(5) 垃圾分类回收等可以节约资源,保护环境。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
产生气体质量(g) | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
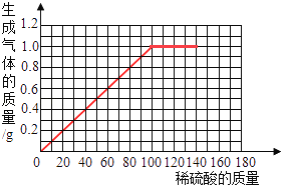
按要求回答下列问题:
(1)根据实验数据分析,从第________份开始,金属已经反应完全了.
(2)列式计算该黄铜样品中金属锌的质量分数________________.(要求写出计算过程)
(3)在给出的坐标纸上,画出40.0g样品中加稀硫酸的质量与产生气体质量的关系曲线____________.
【题目】某化学兴趣小组为了测定镁铜合金中镁的质量分数,取了该合金样品2.0g并将30稀硫酸分6次加入样品中。充分反应后过滤,称重,得到相关数据如下:
稀硫酸的用量 | 剩余固体质量 | 稀硫酸的用量 | 剩余固体质量 |
第一次 5 g | m | 第四次 5 g | 0.8 g |
第二次 5 g | 1.4g | 第五次 5 g | 0.6g |
第三次 5 g | 1.1g | 第六次 5 g | 0.6g |
(1) 表格中m的数值为________。
(2) 样品中镁的质量分数为________。
(3) 求所用硫酸溶液中溶质质量分数为_____________。