题目内容
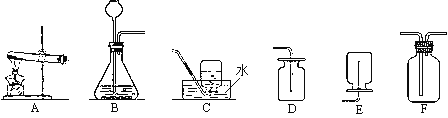
【题目】根据如图1装置,回答有关问题:
(1)装置图中仪器a的名称为_____________________。
(2)采用加热氯酸钾和二氧化锰的混合物制取氧气,可选用的发生装置是_________________, 反应的符号表达式_________________________________。
(3)若用G装置采用排空气法收集氧气,氧气应从____________________进;(选“b”或“c”)
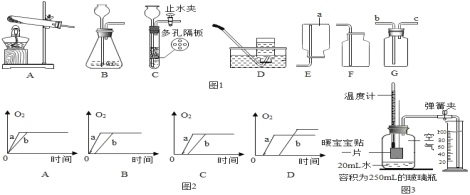
(4)质量相等的两份药品a和b,a是混有少量二氧化锰的氯酸钾,b是纯净的氯酸钾,将药品 分别加热,则收集到氧气的质量随反应时间变化的图象(图2),其中正确的是_____;
(5)收集一瓶氧气,放置一段时间后得到气体甲,某兴趣小组设计使用暖宝宝贴来测定气体 甲中氧气的含量,已知暖宝宝贴(主要成分是铁粉)的热量来源于铁粉的缓慢氧化(即铁的生 锈),实验开始前的装置如图3所示,实验后从量筒中流入集气瓶(容积为250mL)中的水的体 积为69mL(铁粉生锈消耗的水忽略不计)
①关于该实验,下列说法中错误的是______________。
A.如果装置漏气,会使测量结果偏大
B.实验过程中,温度计的示数先升高后降低至室温
C.等温度计的读数恢复至室温后才能记录量筒内剩余的体积
D.读数时,视线与凹液面的最高处保持相平
②通过该实验测得气体甲中氧气的体积分数为____________________。
【答案】集气瓶 A KClO3![]() KCl+O2 b D AD 30%
KCl+O2 b D AD 30%
【解析】
(1)根据实验室常用仪器解答;
(2)发生装置的选择要看反应物的状态和反应条件;氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气写出反应的符号表达式;
(3)根据氧气密度比空气大进行分析;
(4)根据固体氯酸钾在加热条件下可以分解生成氧气。如果用二氧化锰作催化剂则可以加快其分解速度,则a为混有少量二氧化锰的固体氯酸钾,即a反应快,但a中氯酸钾的质量小来解答;
(5)测定空气中氧气含量的实验原理是:药品消耗消耗了瓶内的氧气,生成的是固体,使瓶内压强减小,在外界大气压的作用下水被压进集气瓶,进入水的体积就是集气瓶内原来氧气的体积。
(1)仪器a的名称为:集气瓶;
(2)氯酸钾和二氧化锰在加热的条件下分解,生成氯化钾和氧气,应选用固体加热型发生装置,故选:A,反应的符号表达式为:KClO3![]() KCl+O2;
KCl+O2;
(3)由于氧气的密度比空气大,用G装置采用排空气法收集氧气,氧气应从b进;
(4)因a是混有少量二氧化锰的氯酸钾,b是纯净的氯酸钾,且a和b的质量相等,由于二氧化锰作催化剂可以加快氯酸钾的分解速度,则a反应快,时间短,a中混有二氧化锰,则a中氯酸钾的质量小,则生成的氧气的质量小,故选D;
(5)①A、如果装置漏气,会使进入的水偏少,导致测定结果偏小,选项错误;
B、铁生锈放热,则开始时温度计示数升高,反应完毕后则温度逐渐降低至室温,选项正确;
C、必须等温度计的读数恢复至实验前的温度后,才能记录量筒内剩余水的体积,使结果准确,否则会使结果偏小,选项正确;
D、进行量筒读数时,视线与凹液面的最低处保持相平,而不是最高处,选项错误。故选AD;
②铁生锈消耗氧气,使装置内的气压减小,进入水的体积就是消耗氧气的体积,集气瓶内空气的体积是(250-20)mL=230ml,进入水的体积是69mL,即氧气的体积是69mL,因此氧气的体积分数=![]() ×100%≈30%。
×100%≈30%。

【题目】下表是元素周期表的一部分,则下列叙述正确的是( )
11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
A. 16号元素的离子符号是S-2
B. 氯元素的原子结构示意图是
C. 14号元素是金属元素
D. 12号元素的相对原子质量是12
【题目】小明同学在家里的药箱中发现一瓶用来清洗伤口用的消毒液——“双氧水”,他联想到在化学课上曾用过氧化氢溶液制取过氧气,他高兴的将家中的“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验。
(第一组实验)小明欲证明该双氧水是否失效。
实验过程
①在试管中加入5 mL “双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
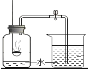
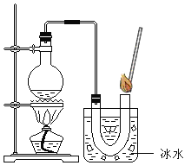
③如图装置进行操作,带火星的木条复燃,
(1)水槽中冰水所起的作用是 __________________________________;
(2)实验结论:___________________________________________________。
(第二组实验)小明想探究CuO能否起到类似MnO2的催化作用。
(3)[猜想]Ⅰ CuO不是催化剂,也不参与反应,反应前后质量和化学性质不变;
Ⅱ CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ CuO是反应的催化剂,反应前后____________________________________
[实验]用天平称量0.2gCuO,取5ml 5%过氧化氢溶液于试管中,进行实验:
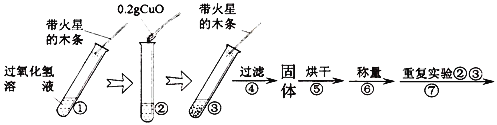
(4)填表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_______; 带火星木条复燃 | ________ | 溶液中有气泡产生; _____________ | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(5)步骤①的目的是____________________________
(6)利用该方法获得氧气的化学方程式为________________
(7)步骤④得到的固体是CuO。CuO的相对分子质量是_______________,其中铜元素的质量分数是________________。
【题目】小明同学欲通过实验证明“二氧化锰是氯酸钾受热分解的催化剂”这一命题。他设计并完成了下表所示的探究实验:
实验操作 | 实验现象 | 实验结论或总结 | ||
各步骤结论 | 总结 | |||
实验一 | 将氯酸钾加热至融化,伸入带火星的木条。 | 木条复燃 | 氯酸钾受热要分解产生氧气,但是__________。 反应的文字或符号表达式为: ____________ | 二氧化锰是氯酸钾受热分解的催化剂。 |
实验二 | 加热二氧化锰,伸入带火星的木条。 | 木条不复燃 | 二氧化锰受热不产生氧气。 | |
实验三 | __________ | 木条迅速复燃 | 二氧化锰能加快氯酸钾的分解。 | |
(1)请你帮小明同学填写上表中未填完的空格;
(2)在小明不同的探究实验中,实验一和实验二起的作用是_________;
(3)小英同学认为仅由上述实验还不能完全得出表内“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是:___________;第二方面的实验是要___________。
(4)过氧化氢溶液在二氧化锰的催化作用下也能产生氧气,写出该反应的符号或文字表达式________,属于_________反应(填“分解”或“化合”)。