题目内容
【题目】为探究酸的化学性质,实验小组设计了如下实验:
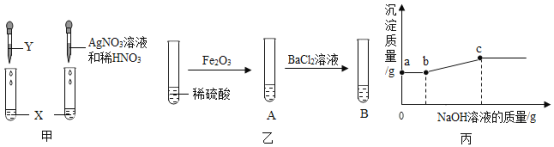
回答下列相关问题。
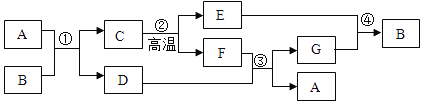
(1)按图甲实验,可确定X是盐酸,则Y可以是____(选填“石蕊”或“酚酞”)溶液;
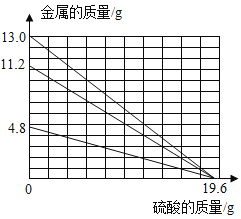
(2)由图乙实验,A中固体全部溶解,B中有白色沉淀产生,得出结论:A中溶质只有Fe2(SO4)3。有同学认为该结论不合理,接着向试管B中滴加NaOH溶液,且产生沉淀的量随NaOH溶液的量的关系如图丙所示,则正确结论是:A中溶质有____。实验中,ab段对应溶液中一定发生反应的化学方程式为____,分别列出c点对应溶液中所含溶质的所有可能情况____;
(3)由以上实验可知,酸能和____(填数字)类物质发生化学反应。
【答案】石蕊 H2SO4、Fe2(SO4)3 NaOH+HCl=NaCl+H2O NaCl;NaCl、BaCl2;NaCl、Na2SO4 4
【解析】
(1)检验物质按图甲实验,可确定X是盐酸,则Y可以是紫色石蕊试液,这是因为稀盐酸能使石蕊试液变红色,而不能使无色酚酞变色;
(2)①接着向试管B中滴加氢氧化钠溶液时,一段时间内不产生沉淀,说明溶液中含有硫酸,氢氧化钠先和硫酸反应生成硫酸钠和水,则A中溶质有Fe2(SO4)3、H2SO4;
②a-b段对应溶液中一定发生的反应是:氯化钡和稀硫酸反应生成的盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为:NaOH+HCl=NaCl+H2O;
③当氯化钡、硫酸铁、稀硫酸恰好完全反应时,溶质只有NaCl;当氯化钡过量时溶质是NaCl 和BaCl2;当硫酸过量时溶质是NaCl、Na2SO4;
(3)由以上实验总结酸的化学性质有:酸能与酸碱指示剂、某些金属氧化物、碱、某些盐反应,因此酸能和4类物质发生化学反应。

【题目】某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
(查阅资料)
①无水硫酸铜是白色固体,吸水变蓝。
②生产原料粗盐中含有少量可溶性杂质(![]() 和
和![]() )及不溶性杂质,生产过程中需先将粗盐精制。
)及不溶性杂质,生产过程中需先将粗盐精制。
③生产原理:![]() 。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是:![]() 。
。
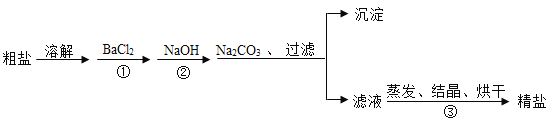
⑤部分生产流程如图所示:
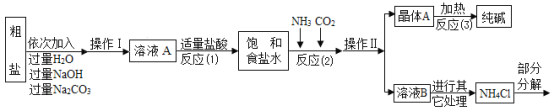
(问题讨论)
(1)①写出加入NaOH溶液所发生反应的化学方程式________。
②反应(1)中加入适量盐酸的目的是________。
(2)上述生产流程中可循环使用的物质是________(填字母)。
A![]() B NaOH C HCl D
B NaOH C HCl D![]()
(组成探究一)
(3)①晶体A受热分解的化学方程式为________。
②设计实验检验纯碱样品中是否混有晶体A,请完成下表(装置从下图中选择)
选择的装置 | 实验现象 | 实验结论 |
________(填字母) | ________ | 样品不含晶体A |
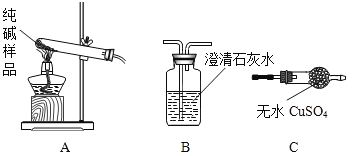
(组成探究二)
(4)取纯碱样品加水溶解,向该溶液中加入过量稀![]() ,再滴加
,再滴加![]() 溶液,有白色沉淀。产生沉淀的化学方程式为________,由此确定纯碱样品含有杂质NaCl。
溶液,有白色沉淀。产生沉淀的化学方程式为________,由此确定纯碱样品含有杂质NaCl。
(组成探究三)
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:
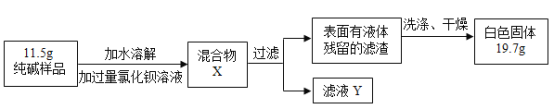
①氯化钡溶液过量的目的是________。判断氯化钡已过量的方法是________。
②判断滤渣是否洗净的方法是:取最后一次洗涤液少许于试管中,滴加________,若无沉淀产生,则已洗净。
③根据实验数据,计算样品中碳酸钠的质量分数为________(列出计算过程,保留一位小数)。
【题目】为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取5g混合物,放入一干净的烧杯中,然后取50g某溶质质量分数的稀硫酸,平均分五次加入其中,充分反应,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀硫酸的质量/g | 10 | 10 | 10 | 10 | 10 |
生成气体的总质量/g | 0.05 | m | 0.15 | 0.18 | n |
(l)上表中m=_____、n=_____.
(2)请计算所用稀硫酸的溶质质量分数(结果保留一位小数).____
(3)固体混合物中,硫酸镁的质量分数为_____.