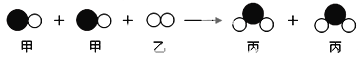��Ŀ����
����Ŀ����ͼ1��ʾ��A��B��CΪ�������ʵ��ܽ�����ߣ������ͼʾ��Ϣ�ش��������⡣
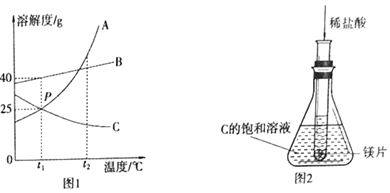
��1��t2��ʱ��A��B��C�����������ܽ����С����_____��
��2��t1��ʱ����30gB����Ͷ��50gˮ�У�����ܽ⣬�¶Ȳ��䣬������ҺΪ_____��Һ������ͻ����͡�����
��3��t2��ʱ����A��B��C�ı�����Һ�ֱ�����t1�棬������Һ���������������Ĵ�С��ϵ��_____��
��4�����ӻ�������B��A��������ȡ�ϴ�����A����ͨ��_____����ʵ�֡�
��5��t1��ʱ������100g����A�ı�����Һ����10%��A��Һ����Ҫ��ˮ_____g����Ҫ�ձ�����Ͳ����ͷ�ιܡ�_____��������
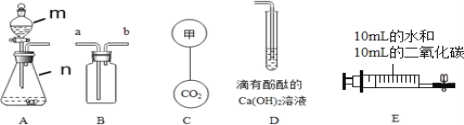
��6����ͼ2��ʾ�������þƬ���Թ��еμ�ϡ�������ƿ��C�ı�����Һ����ǡ������ԭ��_____��
���𰸡�C�� ���ͣ� B��A��C�� ���½ᾧ�� 100�� �������� þ�����ᷴӦ�ų�����ʹ�¶����ߣ�C���ܽ�����¶�����С��
��������
��1��ͨ�������ܽ�����߿�֪��t2��ʱ��A��B��C�����������ܽ����С����C��
��2��t1��ʱ��B���ʵ��ܽ����40g�����Խ�30gB����Ͷ��50gˮ�У�����ܽ⣬�¶Ȳ��䣬������ҺΪ������Һ��
��3��t1��ʱ��B���ʵ��ܽ�����A��C���ʵ��ܽ����ȣ������¶ȣ�A��B���ʵ��ܽ�ȼ�С��C���ʵ��ܽ������Ӧ�ð���t2��ʱ���ܽ�ȼ��㣬����t2��ʱ����A��B��C�ı�����Һ�ֱ�����t1�棬������Һ���������������Ĵ�С��ϵ��B��A��C��
��4��A���ʵ��ܽ�����¶ȱ仯Ӱ��ϴ��������ӻ�������B��A��������ȡ�ϴ�����A����ͨ�����½ᾧ����ʵ�֣�
��5��t1��ʱ������100g����A�ı�����Һ����10%��A��Һ����Ҫ��ˮ![]() ��100g��100g����Ҫ�ձ�����Ͳ����ͷ�ιܡ���������������
��100g��100g����Ҫ�ձ�����Ͳ����ͷ�ιܡ���������������
��6����ͼ2��ʾ�������þƬ���Թ��еμ�ϡ�������ƿ��C�ı�����Һ����ǣ�C���ʵ��ܽ�����¶ȵ����߶���С��ԭ���ǣ�þ�����ᷴӦ�ų�����ʹ�¶����ߣ�C���ܽ�����¶�����С��

����Ŀ���ס��ҡ����������ʵ�ת����ϵ����ͼ��ʾ����������ʾ��Ӧһ��ʵ�֣��������ʺͷ�Ӧ��������ȥ��������ѡ���ʵ��ͼʾת������
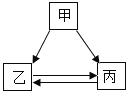
ѡ�� | �� | �� | �� |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | Ca(OH)2 | CaCl2 | CaCO3 |
D | NaOH | NaCl | NaNO3 |
A. A B. B C. C D. D