题目内容
【题目】下列数据是硝酸钾固体在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
(1)硝酸钾溶液中的溶剂是 。
(2)20℃时,向100 g水中加入31.6 g硝酸钾,充分溶解后得到 (填“饱和”或“不饱和”)溶液。
(3)20℃时,向100 g水中加入40 g硝酸钾,若使硝酸钾完全溶解,可采用的方法是 。
(4)如图,小烧杯中盛放的是(2)中所得的硝酸钾溶液。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是 (填字母)
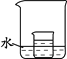
A.冰 B.浓硫酸 C.硝酸铵 D.干冰 E.氢氧化钠 F.氧化钙
(5)向一定量饱和的石灰水中加入少量的生石灰恢复到原温度,产生的现象是 ;其中改变的量是 。(提示:CaO+H2O→Ca(OH)2 )
A.溶质的质量 B.溶剂的质量 C.溶液的质量 D.溶质的质量分数
【答案】(1)水
(2)饱和
(3)加水或升温
(4)A C D
(5)澄清的石灰水变浑浊 A B C
【解析】分析:(1)由化合物化学式的写法可以写出硝酸钾的化学式,进而可以计算氮元素的化合价;根据溶质、溶剂的概念分析溶液中的溶剂.
(2)根据20℃时,硝酸钾的溶解度分析判断即可.
(3)由表中数据分析可知硝酸钾的溶解度随温度的升高而增大,所以要使未溶解的硝酸钾全部溶解,可以采取升温的方法或增加溶剂的方法.
(4)观察表中数据可知,硝酸钾的溶解度随温度的升高而增大.上述(2)中所得的溶液是硝酸钾饱和溶液,所以只要能使饱和溶液温度降低的就能让小烧杯中有固体析出.
解答:解:(1)硝酸钾的化学式为KNO3;由正负化合价代数和为0,可以计算出氮元素的化合价为+5;硝酸钾溶液中,溶质是硝酸钾,溶剂是水;
(2)20℃时硝酸钾的溶解度是31.6g,所以该温度下向100g水中加入31.6g硝酸钾恰好得到硝酸钾的饱和溶液;
(3)因为硝酸钾的溶解度随温度的升高而增大,所以要使硝酸钾饱和溶液中未溶解的硝酸钾溶解,可以采用升温或增加溶剂的方法使其溶解;
(4)因为硝酸钾的溶解度随温度的升高而增大,所以只要能使小烧杯中的温度降低的就可以使固体析出.即只要加到大烧杯中的物质能够吸热即可.A、冰融于水要吸热; B、干冰气化要吸热; C、硝酸铵溶于水要吸热; D、浓硫酸溶于水要放热; E、氢氧化钠溶于水要放热;F、氧化钙溶于水要放热.
故答案为:(1)KNO3;+5;;水;(2)饱和;(3)加水(或加热);(4)ABC.
